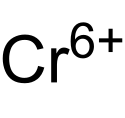Šestimocný chrom
| Šestimocný chrom | |
|---|---|
 | |
 Nejběžnější sloučenina šestimocného chromu: chroman sodný | |
| Obecné | |
| Systematický název | Šestimocný chrom |
| Anglický název | Hexavalent chromium |
| Německý název | Sechswertiges Chrom |
| Sumární vzorec | Cr6+ |
| Identifikace | |
| Registrační číslo CAS | 18540-29-9 |
| EC-no (EINECS/ELINCS/NLP) | 606-053-1 |
| PubChem | 29131 |
| ChEBI | 33007 |
| SMILES | [Cr+6] |
| InChI | InChI=1S/Cr/q+6 Key: JOPOVCBBYLSVDA-UHFFFAOYSA-N |
| Bezpečnost | |
| H-věty | H317, H350, H400, H410 |
| P-věty | P203, P261, P272, P273, P280, P302+352, P318, P321, P333+317, P362+364, P391, P405, P501 |
Některá data mohou pocházet z datové položky. | |
Šestimocný chrom (Cr6+) je chrom v oxidačním stavu +6 (šestimocný) v jakékoli chemické sloučenině. Šestimocný chrom je klíčový pro všechny materiály vyrobené z chromu. V roce 1985 bylo vyrobeno přibližně 136 000 tun šestimocného chromu.[1] Sloučeniny šestimocného chromu mohou být karcinogenní (Biologické karcinogeny skupiny 1), zejména pokud se dostanou do ovzduší mohou způsobit rakovinu plic.
Přehled sloučenin šestimocného chromu
Je známo mnoho kyslíkatých sloučenin šestimocného chromu, zejména ve formě chromanů a dichromanů, které kromě široké škály kationtů obsahují chromanový aniont (CrO 2−
4 ) nebo dichromanový aniont (Cr2O72−). Kromě oxidu chromového (CrO3) lze připravit také peroxid chromový (CrO(O2)2) ve formě stabilních aduktů s vhodnými Lewisovými bázemi. Existují také peroxochromany s jednovaznými kationty M+ s chemickým vzorcem MHCrO2(O2)2. Sloučeniny šestimocného chromu s dusíkem lze připravit ve formě nitridochromanů (M6CrN4) a iminochromanů (M2Cr(NR)4). Binární nitrid (CrN2) a halogenidy (CrX6) nejsou dosud známy,[2] zprávy[3][4] o existenci fluoridu chromového (CrF6) jsou nyní považované za chybnou interpretaci.[5][6] Jsou však známé halogenid-oxidy, jako CrO2Cl2, CrO2F2, nebo CrOF4.[2]
Toxicita
Všechny sloučeniny šestimocného chromu mohou být karcinogenní (Biologické karcinogeny skupiny 1), zejména pokud se dostanou do ovzduší mohou způsobit rakovinu plic. Souvislost byla také pozorována mezi expozicí šestimocnému chromu a rakovinou nosu a vedlejších nosních dutin.[7] Problematicky vystaveni šestimocnému chromu jsou pracovníci, kteří manipulují s chromem, brousí a nebo svařují nerezovou ocel.[8] Pracovníci vystavení šestimocnému chromu mají zvýšené riziko vzniku rakoviny plic, astmatu nebo poškození čichového epitelu a kůže.[9]
Bezpečnostní předpisy
V Evropské unii je používání šestimocného chromu v elektronických zařízení z velké části zakázáno směrnicí RoHS.[10] Od května 2015 již nesmějí být v EU uváděny na trh výrobky z kůže obsahující sloučeniny šestimocného chromu o obsahu vyšším než 3 mg/kg, které přicházejí do styku s kůží.[10] Používání a uvádění na trh cementu, který obsahuje více než 2 mg/kg sloučenin šestimocného chromu a kde existuje riziko kontaktu s kůží, je taktéž zakázáno.[11]
Odkazy
Reference
V tomto článku byly použity překlady textů z článků Hexavalent chromium na anglické Wikipedii a Chrom(VI)-Verbindungen na německé Wikipedii.
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. Příprava vydání Wiley-VCH. 1. vyd. [s.l.]: Wiley Dostupné online. ISBN 978-3-527-30385-4, ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a07_067. (anglicky)
- ↑ a b HOLLEMAN, Arnold F.; WIBERG, Egon; WIBERG, Nils. Lehrbuch der anorganischen Chemie. [s.l.]: Walter de Gruyter 2149 s. Dostupné online. ISBN 978-3-11-017770-1. S. 1567–1572. (německy)
- ↑ GLEMSER, O.; ROESKY, H.; HELLBERG, K.‐H. Preparation of Chromium(V) Fluoride and Chromium(VI) Fluoride. Angewandte Chemie International Edition in English. 1963-05, roč. 2, čís. 5, s. 266–267. Dostupné online [cit. 2023-12-27]. ISSN 0570-0833. DOI 10.1002/anie.196302662. (anglicky)
- ↑ HOPE, Eric G.; LEVASON, William; OGDEN, J. Steven. Is chromium hexafluoride octahedral? Experiment still suggests "yes!". Inorganic Chemistry. 1991-12, roč. 30, čís. 26, s. 4873–4874. Dostupné online [cit. 2023-12-27]. ISSN 0020-1669. DOI 10.1021/ic00026a002. (anglicky)
- ↑ JACOBS, J.; MUELLER, H. S. P.; WILLNER, H. Vibrational and electronic spectra of molecular chromium tetrafluoride, CrF4, and chromium pentafluoride, CrF5. Comments on the existence of chromium hexafluoride, CrF6. Inorganic Chemistry. 1992-12, roč. 31, čís. 26, s. 5357–5363. Dostupné online [cit. 2023-12-27]. ISSN 0020-1669. DOI 10.1021/ic00052a008. (anglicky)
- ↑ RIEDEL, Sebastian; KAUPP, Martin. The highest oxidation states of the transition metal elements. Coordination Chemistry Reviews. 2009-03, roč. 253, čís. 5–6, s. 606–624. Dostupné online [cit. 2023-12-27]. DOI 10.1016/j.ccr.2008.07.014. (anglicky)
- ↑ HUMANS, IARC Working Group on the Evaluation of Carcinogenic Risk to. Arsenic, Metals, Fibres and Dusts. [s.l.]: International Agency for Research on Cancer book s. Dostupné z archivu. ISBN 978-92-832-0135-9. (anglicky)
- ↑ IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. [s.l.]: International Agency for Research on Cancer 700 s. Dostupné z archivu. ISBN 978-92-832-1249-2. (anglicky)
- ↑ 29 CFR OSHA General Industry 1910
- ↑ a b NAŘÍZENÍ KOMISE (EU) č. 301/2014 ze dne 25. března 2014, kterým se mění příloha XVII nařízení Evropského parlamentu a Rady (ES) č. 1907/2006 o registraci, hodnocení, povolování a omezování chemických látek, pokud jde o sloučeniny šestivazného chromu [online]. [cit. 2023-12-27]. Dostupné online.
- ↑ NAŘÍZENÍ EVROPSKÉHO PARLAMENTU A RADY (ES) č. 1907/2006 ze dne 18. prosince 2006 o registraci, hodnocení, povolování a omezování chemických látek, o zřízení Evropské agentury pro chemické látky, o změně směrnice 1999/45/ES a o zrušení nařízení Rady (EHS) č. 793/93, nařízení Komise (ES) č. 1488/94, směrnice Rady 76/769/EHS a směrnic Komise 91/155/EHS, 93/67/EHS, 93/105/ES a 2000/21/ES [online]. [cit. 2023-12-27]. Dostupné online.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Chroman sodný, Na2CrO4
Struktura iontu Cr6+
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances