β-Butyrolakton
| β-Butyrolakton | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | 4-methyloxetan-2-on |
| Ostatní názvy | beta-butyrolakton |
| Sumární vzorec | C4H6O2 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 3068-88-0 |
| EC-no (EINECS/ELINCS/NLP) | 221-330-3 |
| PubChem | 18303 |
| SMILES | CC1CC(=O)O1 |
| InChI | InChI=1/C4H6O2/c1-3-2-4(5)6-3/h3H,2H2,1H3 |
| Vlastnosti | |
| Molární hmotnost | 86,089 g/mol |
| Teplota tání | −43,5 °C (229,6 K)[1] |
| Teplota varu | 71 až 73 °C (344 až 346 K)[1] |
| Hustota | 1,0555 g/cm3 (20 °C)[1] |
| Rozpustnost ve vodě | >10 g/100 ml (23 °C)[1] |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H226 H315 H319 H351[1] |
| P-věty | P201 P202 P210 P233 P240 P241 P242 P243 P264 P280 P281 P302+352 P303+361+353 P305+351+338 P308+313 P321 P332+313 P337+313 P362 P370+378 P403+235 P405 P501[1] |
| Teplota vzplanutí | 60 °C[1] |
Některá data mohou pocházet z datové položky. | |
β-Butyrolakton je organická sloučenina, lakton odvozený od kyseliny beta-hydroxymáselné. Při jeho výrobě vzniká racemická směs. Používá se jako monomer biologicky rozložitelného plastu poly(3-hydroxybutyrát)u (PHB). Polymerizací racemického (RS)-β-butyrolaktonu vzniká polymer kyseliny (RS)-hydroxymáselné, který má ovšem horší vlastnosti (například odolnost vůči rozpadu) než přírodní (R)-poly-3-hydroxybutyrát.[2]
Výroba
β-Butyrolakton se, s 63% výtěžností, vyrábí adicí acetaldehydu na ethenon (za přítomnosti minerálu montmorillonitu.[3]

Potřebný ethenon lze získat dehydrobromací acetylbromidu diisopropylethylaminem. Ethenon reaguje za přítomnosti chirálního komplexu hliníku enantioselektivně za tvorby (S)-β-butyrolaktonu s výtěžností 92 % a enantiomerním přebytkem nad 98 %.[4]

Hydrogenací diketenu za přítomnosti kontaktního palladiového katalyzátoru vzniká β-butyrolakton při výtěžnosti 93 %.[5]

Asymetrickou hydrogenací diketenu pomocí ruthenium-BINAPového katalyzátoru se tvoří opticky aktivní (R)-β-butyrolakton s účinností 97 % a 92% enantiomerním přebytkem.[6]
Při teplotě 50 °C a tlaku CO okolo 6 MPa se (R)-2-methyloxiran karbonyluje na (R)-β-butyrolakton, přičemž konfigurace zůstává zachována z 95 %,[7] je-li jako katalyzátor použit [(salph)Al(THF)2][Co(CO)4][8] (který lze připravit z komplexu [(salph)AlCl a tetrakobaltnanu sodného Na[Co(CO)4]).

Karbonylací 2-methyloxiranu za přítomnosti homogenních porfyrin-karbonylkobaltnanových katalyzátorů v tetrahydrofuranu při tlakuoxidu uhelnatého 1,4 MPa se tvoří β-butyrolakton s výtěžností 97 %.[9]
Kvůli obtížím při oddělování a recyklaci homogenních katalyzátorů byly zkoumány také jejich heterogenní polymerní analogy, při jejich použití se dosahuje podobné výtěžnosti (až 96 %) za tlaku CO 6 MPa. Tyto katalyzátory ovšem nejsou vhodné pro průmyslové využití, protože mají mnohem nižší katalytickou aktivitu.[10]
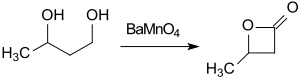
Butan-1,3-diol je možné pomocí manganistanu barnatého (BaMnO4) jako oxidačního činidla v acetonitrilu za působení mikrovlnného záření během jedné hodiny přeměnit na β-butyrolakton s účinností 74 %.[11]
Použití
(R)-β-Butyrolakton reaguje v toluenu s oxidem uhelnatým o tlaku 1,4 MPa a teplotě 55 °C za přítomnosti salenového komplexu po 24 h za vzniku opticky čistého (enantiomerní přebytek nad 99 %) (S)-methylsukcinanhydridu s výtěžností 94 %.[12]

Homo- a kopolymery získávané z β-butyrolaktonu
Výroba kyseliny polyhydroxymáselné (PHB) a homo- a kopolymerních polyhydroxyalkanoátových aerobně biologicky rozložitelných termoplastů zahájená v roce 1983 odstartovala hledání syntetických materiálů, u kterých by se neprojevovaly nedostatky PHB, jako jsou křehkost a tuhost, rozklad již mírně nad teplotami tání (175 až 180 °C) a příliš vysoké náklady[13] v důsledku fermentace, izolace a přečišťování.
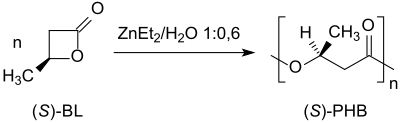
Polymerizací s otevíráním kruhu (S)-β-butyrolaktonu pomocí diethylzinku (ZnEt2) se tvoří poly-(S)-3-hydroxybutyrát s enantiomerním přebytkem nad 97 % při zachování konfigurace na chirálním uhlíku:[14]
Pomocí katalyzátorů ze sloučenin cínu nazývaných distannoxany lze polymerizací (R)-β-butyrolaktonu získat syntetické (R)-polyhydroxybutyráty (Mn > 100 000) se zachováním konfigurace, podobné přírodním polyhydroxyalkanoátům.[15] Aniontovou polymerizací opticky aktivního β-butyrolaktonu vznikají krystalické izotaktické polyhydroxybutyráty s obrácenou konfigurací, které mají nízkou nízká polydisperzitu ( Mw/Mn ≈ 1,2).[16][17]

Silnými zásadami, jako jsou diazabicykloundecen (DBU), 1,5,7-triazabicyklo(4.4.0)dec-5-en (TBD) a fosfazen BEMP, je možné katalyzovat polymerizaci β-butyrolaktonu s otevíráním kruhu při 60 °C za vzniků PHB s nízkými molekulovými hmotnostmi (Mn < 21 000) a jejich užším rozdělením.[18]
Kationtová polymerizace β-butyrolaktonu silnými kyselinami, například kyselinou trifluormethansulfonovou, vede ke vzniku produktů s nižšími molekulovými hmotnostmi (Mn < 8 200) s hydroxylovými skupinami na koncích řetězců, které umožňují kopolymerizaci například s kaprolaktonem.[19]

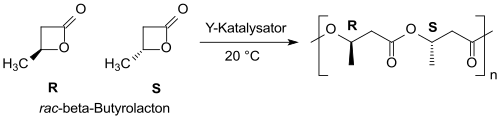
Pomocí yttriových katalyzátorů je možné přeměnit racemický β-butyrolakton na (převážně) syndiotaktický PHB s úzkým rozdělením molekulových hmotností.[20][21]
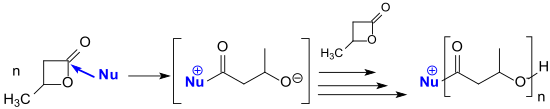
N-heterocyklické karbeny odvozené od imidazol-2-ylidenu jsou silné nukleofily a také vhodné jako iniciátory polymerizace laktonů, jako je β-butyrolakton.[22]
Syntetické PHB, které byly vyvinuté jako homopolymery β-butyrolaktonu nebo jeho kopolymery s ostatními laktony, nemají tak dobré vlastnosti jako biogenní varianty, obzvláště co se týče mechanických a tepelných vlastností a nákladnosti; místo toho se u nich objevují potíže s toxicitou kovů (například cínu, kobaltu či chromu) obsažených v katalyzátorech a atakticitou produktů , které jsou kapalné a obtížně se oddělují.
Reference
V tomto článku byl použit překlad textu z článku β-Butyrolactone na anglické Wikipedii.
- ↑ a b c d e f g h i j beta-Butyrolactone. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ H. Abe; I. Matsubara; Y. Doi. Physical properties and enzymatic degradability of poly(3-hydroxybutyrate) stereoisomers with different stereoregularities. Macromolecules. 1994, s. 6018–6025. doi:10.1021/ma00099a013.
- ↑ US2580714A Production of beta-hydroxy carboxylic acid lactones from ketene and aldehyde with clay catalyst [online]. 1952-01-01 [cit. 2024-09-24]. Dostupné online.
- ↑ S. G. Nelson; W. S. Cheung; A. J. Kassick. A de novo enantioselective total synthesis of (-)-laulimalide. Journal of the American Chemical Society. 2002, s. 13 654 – 13 655. doi:10.1021/ja028019k. PMID 12431077.
- ↑ US2763664A [online]. 1956-09-18 [cit. 2024-09-24]. Dostupné online.
- ↑ T. Ohta; T. Miyake; H. Takaya. An efficient synthesis of optically active 4-methyloxetan-2-one: asymmetric hydrogenation of diketene catalysed by binap–ruthenium(II) complexes [binap = 2,2′-bis(diphenylphosphino)-1,1′-binaphthyl]. ChemComm. 1992, s. 1725–1726. doi:10.1039/C39920001725.
- ↑ Y. D. Y. L. Getzler; V. Mahadevan; E. B. Lobkovsky. Synthesis of β-lactones: a highly active and selective catalyst for epoxide carbonylation. Journal of the American Chemical Society. 2002, s. 1174–1175. doi:10.1021/ja017434u. PMID 11841278.
- ↑ Catalysts for Carbonylation [online]. Sigma Aldrich, 2007 [cit. 2018-12-20]. Dostupné online.
- ↑ US2012123137A1 PROCESS FOR BETA-LACTONE PRODUCTION [online]. 2012-05-17 [cit. 2024-09-24]. Dostupné online.
- ↑ J. Jiang; S. Yoon. A metalated porous porphyrin polymer with [Co(CO)4]− anion as an efficient heterogeneous catalyst for ring expanding carbonylation. Scientific Reports. 2018. doi:10.1038/s41598-018-31475-6. PMID 30185794.
- ↑ M. C. Bagley; Z. Lin; D. J. Phillips; A. E. Graham. Barium manganate in microwave-assisted oxidation reactions: synthesis of lactones by oxidative cyclization reactions. Tetrahedron Letters. 2009, s. 6823–6825. doi:10.1016/j.tetlet.2009.09.117.
- ↑ Y. D. Y. L. Getzler; V. Kundnani; E. B. Lobkovsky; G. W. Coates. Catalytic carbonylation of β-lactones to succinic anhydrides. ournal of the American Chemical Society. 2004, s. 6842–6843. doi:10.1021/ja048946m. PMID 15174834.
- ↑ ICI reduces cost, ups capacity for Biopol [online]. ICIS, 1991-09-22 [cit. 2018-12-20]. Dostupné online.
- ↑ Y. Zhang; R. A. Gross. Stereochemistry of the ring-opening polymerization of (S)-β-butyrolactone. Macromolecules. 1990, s. 3206–3212. doi:10.1021/ma00215a002.
- ↑ Y. Hori; M. Suzuki; A. Yamaguchi; T. Nishishita. Ring-opening polymerization of optically active β-butyrolactone using distannoxane catalysts: Synthesis of high molecular weight poly(3-hydroxybutyrate). Macromolecules. 1993, s. 5533–5534. doi:10.1021/ma00072a037.
- ↑ Z. Jedlinski. First facile synthesis of biomimetic poly (R)-3-hydroxybutyrate via regioselective anionic polymerization of (S)-β-butyrolactone. Macromolecules. 1998, s. 6718–6720. doi:10.1021/ma980663p.
- ↑ R. Kurcak; M. Smiga; Z. Jedlinski. β-Butyrolactone polymerization initiated with tetrabutylammonium carboxylates: a novel approach to biomimetic polyester synthesis. Journal of Polymer Science. 2002, s. 2184–2189. doi:10.1021/ma980663p.
- ↑ C. G. Jaffredo; J.-F. Carpentier; S. M. Guillaume. Controlled ROP of β-butyrolactone simply mediated by amidine, guanidine, and phophazene organocatalysts. Macromol. Rapid Comun.. 2012, s. 1938–1944. doi:10.1002/marc.201200410. PMID 22887774.
- ↑ A. Couffin; B. Martin-Vaca; D. Bourissou; C. Navarro. Selective O-acyl ring-opening of β-butyrolactone catalyzed by trifluoromethane sulfonic acid: application to the preparation of well-defined block copolymers. Polymer Chemistry. 2014, s. 161–168. doi:10.1039/C3PY00935A.
- ↑ A. Amgoune; C. M. Thomas; S. Illinca; T. Roisnel; J.-F. Carpentier. Highly active, productive, and syndiospecific yttrium initiators for the polymerization of racemic β-butyrolactone. Angewandte Chemie International Edition. 2006, s. 2782–2784. doi:10.1002/anie.200600058. PMID 16548028.
- ↑ J.-F. Carpentier. Discrete metal catalysts for stereoselective ring-opening polymerization of chiral racemic β-lactones. Macromol. Rapid Commun.. 2010, s. 1696–1705. doi:10.1002/marc.201000114. PMID 21567583.
- ↑ W. N. Ottou; H. Sardon; D. Mecerryes; J. Vignolle; D. Taton. Update and challenges in organo-mediated polymerization reactions. Progress in Polymer Science. 2016, s. 64–115. Dostupné online. doi:10.1016/j.progpolymsci.2015.12.001.
Externí odkazy
 Obrázky, zvuky či videa k tématu β-butyrolakton na Wikimedia Commons
Obrázky, zvuky či videa k tématu β-butyrolakton na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Ringöffnende kationische Copolymerisation mit beta-Butyrolacton
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Synthese von beta-Butyrolacton mittels Keten aus Acetylbromid
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Synthese von beta-Butyrolacton durch Oxidation von 1,3-Butandiol
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Syndiospezifische Polymerisation von racemischem beta-Butyrolacton
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Polymerisation von beta-Butyrolacton mit N-heterocyclischen Carbenen (NHCs)
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
ynthese von beta-Butyrolacton aus Acetaldehyd und Keten
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Ringöffnende Polymerisation (ROP) von (S)-beta-Butyrolacton zu Poly-(S)-3-hydroxybutyrat
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Anionische ringöffnende Polymerisation von beta-Butyrolacton
Autor: Souna23, Licence: CC BY-SA 4.0
Strukturní vzorec β-Butyrolaktonu
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Synthese von beta-Butyrolacton durch Carbonylierung von Propylenoxid
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Synthese von beta-Butyrolacton aus Diketen
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Methylbernsteinsäureanhydrid durch Carbonylierung von beta-Butyrolacton

















