(E)-stilben
| (E)-stilben | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 1,1′-[(E)-ethen-1,2-diyl]dibenzen |
| Ostatní názvy | trans-1,2-difenylethen, trans-stilben |
| Funkční vzorec | C6H5CH=CHC6H5 |
| Sumární vzorec | C14H12 |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 103-30-0 |
| EC-no (EINECS/ELINCS/NLP) | 209-621-3 |
| PubChem | 638088 |
| ChEBI | 36007 |
| SMILES | c1ccc(cc1)/C=C/c1ccccc1 |
| InChI | InChI=1S/C14H12/c1-3-7-13(8-4-1)11-12-14-9-5-2-6-10-14/h1-12H/b12-11+ |
| Vlastnosti | |
| Molární hmotnost | 180,25 g/mol |
| Teplota tání | 124 °C (397 K)[1] |
| Teplota varu | 307 °C (580 K)[1] |
| Hustota | 0,9707 g/cm3 (20 °C)[1] |
| Rozpustnost ve vodě | nerozpustný[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu a diethyletheru[1] |
| Tlak páry | 0,117 Pa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H319 H411[1] |
| P-věty | P264 P264+265 P270 P273 P280 P301+317 P305+351+338 P330 P337+317 P391 P501[1] |
| Teplota vzplanutí | >112 °C (>385 K) |
Některá data mohou pocházet z datové položky. | |
(E)-Stilben, také nazývaný trans-stilben, je organická sloučenina se vzorcem C6H5CH=CHC6H5. Z hlediska struktury obsahuje její molekula dvojici fenylových skupin napojených na ethen-1,2-diylovou skupinu na opačných stranách dvojné vazby; vzniká tak (E) geometrický izomer, čímž se sloučenina liší od cis, který má oba fenyly na stejné straně a vykazuje tak (Z) stereochemii. trans-Stilben je za pokojové teploty bílou krystalickou látkou, roztpustnou v organických rozpouštědlech. Dá se fotochemicky přeměnit na cis-stilben, z něhož je poté možné vytvořit fenanthren. Stilben objevil francouzský chemik Auguste Laurent v roce 1843.[2]
Izomery
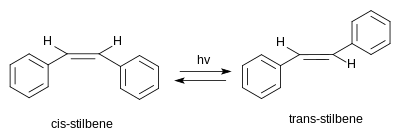
Stilben má dva stereoizomery; trans-1,2-difenylethen, neboli (E)-stilben či trans-stilben, a cis-1,2-difenylethen, neboli (Z)-stilben či cis-stilben. Druhý z nich vykazuje výrazné sterické efekty mezi aromatickými kruhy, které brání konjugaci, v důsledku čehož je tento izomer méně stabilní.[3]
cis-Stilben je za pokojové teploty kapalný, s teplotou tání 5–6 °C, zatímco trans-stilben je krystalickou pevnou látkou, tající až při 125 °C.[4][5]
Tlaky páry u stilbenů[6]
| Izomer | Teplota (°C) | Tlak páry (kPa) |
|---|---|---|
| cis-stilben | 100 | 0,199 |
| cis-stilben | 125 | 0,765 |
| cis-stilben | 150 | 2,51 |
| trans-stilben | 150 | 0,784 |
Příprava a reakce
Je známa řada syntéz trans-stilbenu. Jednou z nich je redukce benzoinu zinkovým amalgámem.[5]
- C6H5–CH(OH)–C(=O)–C6H5 trans-C6H5–CH=CH–C6H5
Oba izomery lze získat dekarboxylací kyseliny alfa-fenylskořicové, trans-stilben vzniká ze (Z)-izomeru kyseliny.[4]
Richard F. Heck[7] a Cutomu Mizoroki[8] nezávisle na sobě popsali tvorbu trans-stilbenu reakcí jodbenzenu se styrenem za přítomnosti palladnatého katalyzátoru, později nazvanou Mizorokiova-Heckova reakce.[9][10]
Stilben vstupuje do reakcí obvyklých u alkenů. Trans-stilben lze epoxidovat kyselinou peroxymonofosforečnou, H3PO5, kdy v dioxanu vzniká stilbenoxid se 74% výtěžností;[11] produktem je racemická směs obou enantiomerů 1,2-difenyloxiranu. Z cis-stilbenu se vytváří nechirální mezo (1R,2S)-1,2-difenyloxiran, ale epoxidace cis-izomeru peroxidy vytváří i cis- a trans-produkty; například při použití terc-butylhydroperoxidu vzniká z cis-stilbenu 0,8 % cis-stilbenoxidu, 13,5 % trans-stilbenoxidu a 6,1 % benzaldehydu.[12][13]
Enantiomerně čistý stilbenoxid připravil Karl Barry Sharpless.[14]
Stilben lze převést na benzaldehyd prostřednictvím ozonolýzy[15] nebo Lemieuxovy–Johnsonovy oxidace; silnější oxidační činidla, jako například okyselený manganistan draselný, oxidují dále, až na kyselinu benzoovou. Vicinální dioly lze získat Upjohnovou dihydroxylací nebo, enantioselektivně, Sharplessovou asymetrickou dihydroxylací,[16][17] jejíž enantiomerní přebytek může být až 100 %.[18][19][20]
Bromací trans-stilbenu vzniká převážně meso-1,2-dibrom-1,2-difenylethan (také nazývaný meso-stilbendibromid); mechanismus zahrnuje jako meziprodukt bromoniový ion, jak lze očekávat u elektrofilní adice halogenu;[21] z cis-stilbenu v nepolárních rozpouštědlech, jako je tetrachlormethan, se tvoří racemická směs obou enantiomerů 1,2-dibrom-1,2-difenylethanu, s rostoucí polaritou rozpouštědla se ale zvyšuje tvorba meso sloučeniny, která například u nitromethanu tvoří 90 % směsi produktů.[22]
Tvorba malých množství obou enantiomerů stilbendibromidu z trans-izomeru naznačuje, že bromoniový meziprodukt vytváří rovnováhu s karbokationtem PhCHBr–C+(H)Ph, který má prázdný orbital p náchylný k nukleofilním atakům z obou stran.[21] Adice bromidů a tribromidů jsou výrazně stereospecifické i v rozpouštědlech s relativní permitivitou nad 35.[23]
Působením ultrafialového záření se trans-stilben mění na cis-stilben, přičemž reakce může pokračovat dále k fenanthrenu.[24]
Deriváty a jejich použití
Syntetické
Samotný (E)-stilben nemá mnoho využití, ale používá se na výrobu dalších sloučenin, používaných jako barviva, optické zjasňovače, fosforescenční látky a scintilátory.[25]
Stilben je jednou z látek používaných jako aktivní média v barvivových laserech.[26]


4,4'-dinitrostilben-2,2'-disulfonát disodný se získává sulfonací 4-nitrotoluenu za vzniku kyseliny 4-nitrotoluen-2-sulfonové, který se poté může za přítomnosti chlornanu sodného přeměnit na derivát (E)-stilbenu.[27][28]
Byly nalezeny podobné reakce s vyššími výtěžnostmi, využívající oxidaci v kapalném amoniaku za přítomnosti vzduchu.[29] Produkt může reagovat s deriváty anilinu za vzniku azobarviv.[26]
Přírodní stilbeny
Přírodní deriváty stilbenů se nazývají stilbenoidy; do této skupiny patří například resveratrol a pterostilben. Stilbestroly, které jsou strukturně, ovšem nikoliv synteticky, podobné (E)-stilbenu, mají estrogenní účinky; do této skupiny patří látky jako diethylstilbestrol, fosfestrol a dienestrol. Některé sloučeniny z této skupiny vznikají kondenzacemi derivátů koenzymu A a kyseliny skořicové nebo 4-hydroxyskořicové s kyselinou malonovou.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku (E)-Stilbene na anglické Wikipedii.
- ↑ a b c d e f g h i j https://pubchem.ncbi.nlm.nih.gov/compound/638088
- ↑ Auguste Laurent. Mémoire sur la série stilbique. Comptes rendus. 1843, s. 856–860.
- ↑ Ernest L. Eliel; Samuel H. Wilen. Stereochemistry of Organic Compounds. [s.l.]: John Wiley and Sons, 1994. Dostupné online. ISBN 0-471-01670-5. S. 566–567.
- ↑ a b BUCKLES, Robert E.; WHEELER, Norris G. cis-Stilbene. Org. Synth.. 1953, s. 88. Dostupné online. DOI 10.15227/orgsyn.033.0088.; Coll. Vol.. S. 857.
- ↑ a b SHRINER, R. L.; BERGER, Alfred. trans-Stilbene. Org. Synth.. 1943, s. 86. Dostupné online. DOI 10.15227/orgsyn.023.0086.; Coll. Vol.. S. 786.
- ↑ David Lide. CRC Handbook of Chemistry and Physics. [s.l.]: CRC Press, 1995. Dostupné online. ISBN 0-8493-0476-8.
- ↑ R. F. Heck; J. P. Nolley. Palladium-catalyzed vinylic hydrogen substitution reactions with aryl, benzyl, and styryl halides. The Journal of Organic Chemistry. 1972, s. 2320–2322. DOI 10.1021/jo00979a024.
- ↑ Tsutomu Mizoroki; Kunio Mori; Atsumu Ozaki. Arylation of Olefin with Aryl Iodide Catalyzed by Palladium. Bulletin of the Chemical Society of Japan. 1971, s. 581. DOI 10.1246/bcsj.44.581.
- ↑ Richard F. Heck. Palladium-catalyzed vinylation of organic halides. Organic Reactions. 1982, s. 345–390. ISBN 0471264180. DOI 10.1002/0471264180.or027.02.
- ↑ Irina P. Beletskaya; Andrei V. Cheprakov. The Heck Reaction as a Sharpening Stone of Palladium Catalysis. Chemical Reviews. 2000, s. 3009–3066. DOI 10.1021/cr9903048. PMID 11749313.
- ↑ Yoshiro Ogata; Kohtaro Tomizawa; Toshiyuki Ikeda. Oxidation of trans-stilbene with peroxymonophosphoric acid. The Journal of Organic Chemistry. 1979, s. 2362–2364. DOI 10.1021/jo01328a006.
- ↑ Guochuan Yin; Andrew M. Danby; David Kitko; John D. Carter; William M. Scheper; Daryle H. Busch. Olefin Epoxidation by Alkyl Hydroperoxide with a Novel Cross-Bridged Cyclam Manganese Complex: Demonstration of Oxygenation by Two Distinct Reactive Intermediates. Inorganic Chemistry. 2007, s. 2173–2180. DOI 10.1021/ic061957r.
- ↑ Daryle H. Busch; Guochuan Yin; Hyun-Jin Less. Mechanisms in Homogeneous and Heterogeneous Epoxidation Catalysis. Příprava vydání S. Ted Oyama. [s.l.]: Elsevier, 2011. ISBN 9780080558011. Kapitola Lewis Acid Catalyzed Epoxidation of Olefins Using Hydrogen Peroxide: Growing Prominence and Expanding Range, s. 119–153.
- ↑ Han-Ting Chang; K. Barry Sharpless. Molar Scale Synthesis of Enantiopure Stilbene Oxide. The Journal of Organic Chemistry. 1996, s. 6456–6457. DOI 10.1021/jo960718q. PMID 11667495.
- ↑ Clyde E. Bishop; Donald D. Denson; Paul R. Story. Mechanisms of ozonolysis. The cis, trans-stilbene system. Tetrahedron Letters. 1968, s. 5739–5742. DOI 10.1016/S0040-4039(00)76338-6.
- ↑ Eric N. Jacobsen; Istvan Marko; William S. Mungall; Georg Schroeder; K. Barry Sharpless. Asymmetric dihydroxylation via ligand-accelerated catalysis. Journal of the American Chemical Society. 1988, s. 1968–1970. DOI 10.1021/ja00214a053.
- ↑ Hartmuth C. Kolb; Michael S. VanNieuwenhze; K. Barry Sharpless. Asymmetric dihydroxylation via ligand-accelerated catalysis. Chemical Reviews. 1994, s. 2483–2547. DOI 10.1021/cr00032a009.
- ↑ Zhi-Min Wang; K. Barry Sharpless. A Solid-to-Solid Asymmetric Dihydroxylation Procedure for Kilogram-Scale Preparation of Enantiopure Hydrobenzoin. The Journal of Organic Chemistry. 1994, s. 8302–8303. DOI 10.1021/jo00105a065.
- ↑ MCKEE, Blaine H.; GILHEANY, Declan G.; SHARPLESS, K. Barry. (R,R)-1,2-Diphenyl-1,2-ethanediol (Stilbene Diol). Org. Synth.. 1992, s. 47. Dostupné online. DOI 10.15227/orgsyn.070.0047.; Coll. Vol.. S. 383.
- ↑ Atta-ur-Rahman. Stereoselectove Synthesis in Organic Chemistry. [s.l.]: Springer-Verlag, 1993. ISBN 9781461383277. Kapitola Asymmetric Hydroxylations, s. 406–410.
- ↑ a b John C. Gilbert; Stephen F. Martin. Experimental Organic Chemistry: A Miniscale and Microscale Approach. [s.l.]: Cengage Learning, 2010. ISBN 9781439049143. Kapitola 10.6 – Bromination of Alkenes, s. 376–383.
- ↑ Robert E. Buckles; Jane M. Bader; Roland J. Thurmaier. Stereospecificity of the Addition of Bromine to cis- and trans-Stilbene. The Journal of Organic Chemistry. 1962, s. 4523–4527. DOI 10.1021/jo01059a097.
- ↑ Roberto Bianchini; Cinzia Chiappe. Stereoselectivity and reversibility of electrophilic bromine addition to stilbenes in chloroform: influence of the bromide-tribromide-pentabromide equilibrium in the counteranion of the ionic intermediates. The Journal of Organic Chemistry. 1992, s. 6474–6478. DOI 10.1021/jo00050a021.
- ↑ S. P. Kwasniewski; L. Claes; J.-P. François; M. S. Deleuze. High level theoretical study of the structure and rotational barriers of trans-stilbene. The Journal of Chemical Physics. 2003, s. 7823–7836. DOI 10.1063/1.1563617. Bibcode 2003JChPh.118.7823K.
- ↑ Peter F. Vogt; John J. Gerulis. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2000. ISBN 3527306730. DOI 10.1002/14356007.a02_037. Kapitola Amines, Aromatic.
- ↑ a b Klaus Hunger; Peter Mischke; Wolfgang Rieper; Roderich Raue; Klaus Kunde; Aloys Engel. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2005. ISBN 3527306730. DOI 10.1002/14356007.a03_245. Kapitola Azo Dyes.
- ↑ William M. Cumming; I. Vance Hopper; T. Sherlock Wheeler. Systematic Organic Chemistry: Modern Methods of Preparation and Estimation. New York: D. Van Nostrand Company, 1926. Kapitola Preparation 294.—Dinitro-Stilbene-Disulphonic Acid (Na salt).
- ↑ Arthur G. Green. Ueber die Oxydation von Paranitrotoluolsulfosäure. Berichte der Deutschen Chemischen Gesellschaft. 1897, s. 3097–3101. Dostupné online. DOI 10.1002/cber.189703003128.
- ↑ Process for the preparation of 4,4'-dinitrostilbene-2,2-disulfonic acid. Původce vynálezu: Guglielmetti LEONARDO. US. Patentový spis US5041632A. 1991-08-20. Dostupné: <online> [cit. 2022-10-17].
Externí odkazy
 Obrázky, zvuky či videa k tématu (E)-stilben na Wikimedia Commons
Obrázky, zvuky či videa k tématu (E)-stilben na Wikimedia Commons - (E)-stilben na ChemExper
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Ball-and-stick model of the trans-stilbene molecule, C14H12, also known as (E)-stilbene.
X-ray crystallographic data from C. J. Finder, M. G. Newton and N. L. Allinger (February 1974). "An improved structure of trans-stilbene". Acta Cryst. B30 (2): 411-415. DOI:10.1107/S0567740874002913.
Image generated in Accelrys DS Visualizer.Oxidation of trans-stilbene with peroxomonophosphoric acid
Stilbene isomerization
Autor: Dissolution, Licence: CC BY-SA 3.0
Mizoroki-Heck 1971 iodobenzene styrene
Chemical diagram for diaminostilbene disulfonic acid
Structure of Diethylstilbestrol














