1-propanol
| 1-propanol | |
|---|---|
 Strukturní vzorec 1-propanolu | |
| Obecné | |
| Systematický název | Propan-1-ol |
| Triviální název | Propanol |
| Ostatní názvy | n-propanol, propylalkohol |
| Anglický název | 1-Propanol |
| Německý název | 1-Propanol |
| Funkční vzorec | CH3CH2CH2OH |
| Sumární vzorec | C3H8O |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 71-23-8 |
| EC-no (EINECS/ELINCS/NLP) | 200-746-9 |
| Indexové číslo | 603-003-00-0 |
| SMILES | CCCO |
| Vlastnosti | |
| Molární hmotnost | 60,1 g/mol |
| Teplota tání | −126,5 °C |
| Teplota varu | 97,1 °C (370,3 K) |
| Hustota | 0,803 4 g/cm³ (kapalina) |
| Viskozita | 1,938 cP (25 °C) |
| Disociační konstanta pKa | (~16) |
| Rozpustnost ve vodě | neomezená |
| Struktura | |
| Dipólový moment | 1,68 D |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H225 H318 H336 |
| R-věty | R11, R41, R67 |
| S-věty | S2, S7, S16, S24, S26, S39 |
| NFPA 704 | |
| Teplota vznícení | 15 °C |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Propan-1-ol (též 1-propanol, n-propanol, 1-propylalkohol, n-propylalkohol, nebo jednoduše propanol či propylalkohol) je primární alkohol s chemickým vzorcem CH3CH2CH2OH. Je izomerem propan-2-olu (isopropylalkoholu). Používá se jako rozpouštědlo ve farmaceutickém průmyslu, do pryskyřic a celulózových esterů. V malých dávkách vzniká přirozeně při mnoha fermentačních procesech.
Chemické vlastnosti
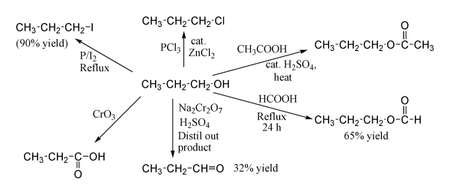
1-propanol vykazuje normální chování primárního alkoholu. Proto ho lze převést na alkylhalogenidy. Například červený fosfor a jod tvoří n s 90% výtěžností, zatímco chlorid fosforečný s katalyzátorem chloridem zinečnatým dává 1-chlorpropan. Reakce s kyselinou octovou za přítomnosti kyseliny sírové jako katalyzátoru a podmínek Fischerovy esterifikace poskytuje propylacetát, kdežto flegmace propanolu s kyselinou mravenčí může poskytovat propylformát s výtěžností 65 %. Oxidace 1-propanolu dichromanem sodným a H2SO4 dává pouze 36% výtěžnost propionaldehydu a proto se pro tento typ reakce doporučují metody s vyšší výtěžností, za použití PCC nebo Swernovy oxidace. Oxidace kyselinou chromovou poskytuje kyselinu propionovou.
Příprava
1-propanol je hlavní složkou přiboudliny, vedlejšího produktu určitých aminokyselin při fermentaci brambor a obilí na ethanol. Toto ale není významným zdrojem propanolu.
1-propanol se vyrábí katalytickou hydrogenací propionaldehydu. Propionaldehyd se pak vyrábí oxosyntézou, hydroformylací ethenu oxidem uhelnatým a vodíkem za přítomnosti katalyzátoru, např. dikobaltoktakarbonylového nebo rhodiového komplexu.
- (1) H2C=CH2 + CO + H2 → CH3CH2CH=O
- (2) CH3CH2CH=O + H2 → CH3CH2CH2OH
Tradiční laboratorní příprava 1-propanolu spočívá v reakci n s vlhkým oxidem stříbrným.
Historie
1-propanol byl objeven Chancelem v roce 1853 při frakční destilaci přiboudliny.
Reference
V tomto článku byl použit překlad textu z článku Propan-1-ol na anglické Wikipedii.
- ↑ a b Propanol. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- Perkin, W. H.; Kipping, F. S. (1922). Organic Chemistry, London: W. & R. Chambers.
Externí odkazy
 Obrázky, zvuky či videa k tématu 1-propanol na Wikimedia Commons
Obrázky, zvuky či videa k tématu 1-propanol na Wikimedia Commons - International Chemical Safety Card 0553
- NIOSH Pocket Guide to Chemical Hazards
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Some reactions of propan-1-ol, drawn in ChemDraw and uploaded by User:Walkerma in September 2005.