2,5-dimethylfuran
| 2,5-dimethylfuran | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 2,5-dimethylfuran |
| Sumární vzorec | C6H8O |
| Vzhled | žlutá olejovitá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 625-86-5 |
| EC-no (EINECS/ELINCS/NLP) | 210-914-3 |
| PubChem | 12266 |
| ChEBI | 89052 |
| SMILES | CC1=CC=C(O1)C |
| InChI | 1S/C6H8O/c1-5-3-4-6(2)7-5/h3-4H,1-2H3 |
| Vlastnosti | |
| Molární hmotnost | 96,127 g/mol |
| Teplota tání | −62,8 °C (210,4 K)[1] |
| Teplota varu | 93,5 °C (366,6 K)[1] |
| Hustota | 2,1683 g/cm3[1] |
| Rozpustnost ve vodě | málo rozpustný[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu[1] |
| Tlak páry | 7,0 kPa (22 °C)[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H302 H315 H317 H319 H335[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P261 P264 P264+265 P270 P271 P272 P280 P301+317 P302+352 P303+361+353 P304+340 P305+351+338 P319 P321 P330 P332+317 P333+313 P337+317 P362+364 P370+378 P403+233 P403+235 P405 P501[1] |
| Teplota vzplanutí | −1 °C (272 K)[1] |
| Teplota vznícení | 286 °C (559 K)[2] |
Některá data mohou pocházet z datové položky. | |
2,5-dimethylfuran je heterocyklická organická sloučenina se vzorcem (CH3)2C4H2O. Má možné využití jako biopalivo, získatelné z celulózy.
Výroba
Fruktózu lze katalyticky přeměnit na 2,5-dimethylfuran; meziproduktem je přitom hydroxymethylfurfural.[3][4]
Fruktóza se dá získat z glukózy, vznikající rozkladem celulózy.[5][6]
Využití jako biopalivo
2,5-dimethylfuran má řadu vlastností, díky kterým je použitelný jako biopalivo. Jeho hustota energie je o 40 % vyšší než u ethanolu a podobná, jakou má benzin. Látka je také chemicky stálá a nerozpustná ve vodě, neabsorbuje tak vzdušnou vlhkost. Odpařování dimethylfuranu vyžaduje oproti ethanolu přibližně o třetinu méně energie,[3][7] přestože je jeho teplota varu, 92 °C, o 14 °C vyšší než u ethanolu (78 °C).
Možnost rychlé výroby dimethylfuranu z fruktózy, získatelné z ovoce a některých druhů zeleniny, nebo glukózy, kterou lze vyrobit ze škrobu a celulózy, snadno dostupných z přírodních zdrojů – zvyšuje zájem o dimethylfuran. Nejčastějšími biopalivy jsou však bioethanol a bionafta.
Stechiometrický poměr vzduch/palivo činí u dimethylfuranu 10,72, zatímco u ethanolu 8,95 a u benzinu 14,56.[2] Ke spálení dimethylfuranu tak stačí o asi 33 % méně vzduchu než u benzinu, ovšem přibližně o 20 % více, než u stejného množství ethanolu.
Spalné teplo kapalného dimethylfuranu je 33,7 MJ/kg, u ethanolu 26,9 MJ/kg a u benzinu 43,2 MJ/kg.[2] Oktanové číslo má hodnotu 119.[2] Měrné skupenské teplo varu činí 31,91 kJ/mol při 20 °C.[2] Tepelná účinnost spalování dimethylfuranu se podobá benzinu.[8]
Ostatní použití
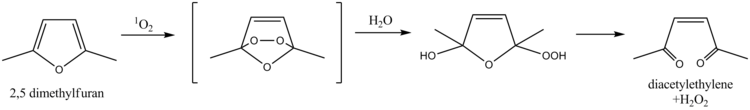
2,5-dimethylfuran se dá použít k zachytávání singletového kyslíku a jeho stanovení ve vodě. Mechanismus spočívá v Dielsově–Alderově reakci a hydrolýze, které vedou ke vzniku diacetylethylenu a peroxidu vodíku. Ke stejnému účelu může sloužit i furfurylalkohol.[9]
2,5-dimethylfuran byl také navržen jako interní standard v NMR spektroskopii. 2,5-dimethylfuran má singlety v 1 spektru na δ 2,2 a 5,8. Teplota varu 92 °C omezuje ztráty vypařováním i snadné odstranění.[10]
V chemii potravin
2,5-dimethylfuran se vytváří tepelným rozkladem některých sacharidů a byl ve stopových množstvích nalezen v karamelizovaných cukrech.[11]
Toxikologie
2,5-dimethylfuran je součástí mechanismu neurotoxicity hexanu u lidí, jehož je, společně s hexan-2,5-dionem a 4,5-dihydroxy-hexan-2-onem, jedním z hlavních metabolitů.[12]
2,5-dimethylfuran se také nachází v cigaretovém kouři, kde poškozuje řasinky v dýchacím ústrojí, které mají odstraňovat cizorodé částice.[13] Jeho koncentraci v krvi je možné využít jako biomarker kouření.[14]
Srovnání bezpečnostních listů ukazuje,[15][16][17] že nakládání s 2,5-dimethylfuranem je srovnatelně nebezpečné jako v případě benzinu.[18][19][20]
Reference
V tomto článku byl použit překlad textu z článku 2,5-Dimethylfuran na anglické Wikipedii.
- ↑ a b c d e f g h i j k https://pubchem.ncbi.nlm.nih.gov/compound/12266
- ↑ a b c d e Direct-Injection Engine Study Finds That DMF Is a Promising Biofuel, With Combustion Performance and Regulated Emissions Comparable to Gasoline | Eco Friendly [online]. Dostupné v archivu pořízeném z originálu dne 2013-01-21. (anglicky)
- ↑ a b Yuriy Román-Leshkov; Christopher J. Barrett; Zhen Y. Liu; James A. Dumesic. Production of dimethylfuran for liquid fuels from biomass-derived carbohydrates. Nature. 2007, s. 982–985. DOI 10.1038/nature05923. PMID 17581580.
- ↑ Matt McGrath. Fruit could make 'powerful fuel' [online]. BBC News, 2007-06-21 [cit. 2007-06-22]. Dostupné v archivu pořízeném z originálu dne 2007-08-17.
- ↑ Haibo Zhao; Johnathan E. Holladay; Heather Brown; Z. Conrad Zhang. Metal Chlorides in Ionic Liquid Solvents Convert Sugars to 5-Hydroxymethylfurfural. Science. 2007-06-15, s. 1597–1600. DOI 10.1126/science.1141199. PMID 17569858.
- ↑ Plastic that grows on trees [online]. Pacific Northwest National Laboratory, 2007-06-21 [cit. 2007-06-22]. Dostupné v archivu pořízeném z originálu dne 2007-07-13.
- ↑ James Beal. Engineers develop higher-energy liquid-transportation fuel from sugar [online]. University of Wisconsin-Madison, 2007-06-20 [cit. 2007-06-22]. Dostupné v archivu pořízeném z originálu dne 2007-07-01.
- ↑ Green Car Congress: Direct-Injection Engine Study Finds That DMF Is a Promising Biofuel, With Combustion Performance and Regulated Emissions Comparable to Gasoline [online]. [cit. 2011-03-17]. Dostupné v archivu pořízeném z originálu dne 2011-12-24.
- ↑ Patrick L. Brezonik. Chemical Kinetics and Process Dynamics in Aquatic Systems. CRC Press, 1994, p. 671. [1] Archivováno 24. 7. 2020 na Wayback Machine.
- ↑ S. W. Gerritz; A. M. Sefler. 2,5-Dimethylfuran (DMFu): An Internal Standard for the "Traceless" Quantitation of Unknown Samples via 1H NMR. ACS Combinatorial Science. 2000, s. 39–41. DOI 10.1021/cc990041v. PMID 10813883.
- ↑ W. D. Powrie; C. H. Wu; V. P. Molund. Browning reaction systems as sources of mutagens and antimutagens. Environmental Health Perspectives. 1986, s. 47–54. DOI 10.2307/3430317. PMID 3757959.
- ↑ Peter Arlien-Søborg. Solvent Neurotoxicity. CRC Press, 1992. ISBN 0-8493-6234-2. [2] Archivováno 21. 2. 2021 na Wayback Machine.
- ↑ Donald Shopland. Cigars: Health Effects and Trends. DIANE Publishing, 1998. [3] Archivováno 24. 7. 2020 na Wayback Machine.
- ↑ ASHLEY, D. L.; BONIN, M. A.; HAMAR, B.; MCGEEHIN, M. Using the blood concentration of 2,5-dimethylfuran as a marker for smoking. International Archives of Occupational and Environmental Health. 1996, s. 183–7. Dostupné v archivu pořízeném z originálu dne 2021-02-21. DOI 10.1007/BF00381629. PMID 8919847. S2CID 22233967. (anglicky)
- ↑ Safety Data Sheet: 2,5-Dimethylfuran [online]. [cit. 2014-03-07]. Dostupné v archivu pořízeném z originálu dne 2014-03-07. (anglicky)
- ↑ 2,5-Dimethylfuran(625-86-5) [online]. [cit. 2017-07-21]. Dostupné v archivu pořízeném z originálu dne 2017-05-04. (anglicky)
- ↑ Material Safety Data Sheet: 2,5-Dimethylfuran [online]. Dostupné online. (anglicky)[nedostupný zdroj]
- ↑ Equiva Services - MSDS [online]. Dostupné v archivu pořízeném z originálu dne 2011-07-10. (anglicky)
- ↑ hazard.com [online]. [cit. 2010-12-27]. Dostupné v archivu pořízeném z originálu dne 2011-07-11. (anglicky)
- ↑ hazard.com [online]. [cit. 2010-12-27]. Dostupné v archivu pořízeném z originálu dne 2011-07-11. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu 2,5-dimethylfuran na Wikimedia Commons
Obrázky, zvuky či videa k tématu 2,5-dimethylfuran na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Autor: Own work by Kieranmrhunt (talk) at en.wikipedia. Transferred from en.wikipedia to Commons by User:Teratornis using CommonsHelper. Vectorized by Magsjukur2, Licence: CC0
An image of 2,5-dimethylfuran
Chemical structure of 2,5-dimethylfuran
The reaction of dimethylfuran with singlet oxygen, drawn with ChemDraw