2-pyridon
| 2-pyridon | |
|---|---|
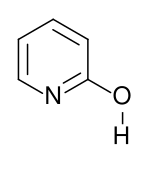
 Strukturní vzorec laktimové formy | |
 Strukturní vzorec laktamové formy | |
 Model molekuly laktamové formy | |
| Obecné | |
| Systematický název | pyridin-2(1H)-on |
| Sumární vzorec | C5H5NO |
| Vzhled | bezbarvá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 142-08-5 |
| EC-no (EINECS/ELINCS/NLP) | 205-520-3 |
| PubChem | 8871 |
| ChEBI | 16540 |
| SMILES | Oc1ccccn1 (laktimová forma) C1=CC=CNC(=O)1 (laktamová forma) |
| InChI | 1S/C5H5NO/c7-5-3-1-2-4-6-5/h1-4H,(H,6,7) |
| Číslo RTECS | UV1144050 |
| Vlastnosti | |
| Molární hmotnost | 95,099 g/mol |
| Teplota tání | 107,8 °C (381,0 K)[1] |
| Teplota varu | 280 °C (553 K)[1] |
| Rozpustnost ve vodě | 100 g/100 ml (20 °C)[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v methanolu a acetonu |
| Bezpečnost | |
| [1] | |
| H-věty | H301 H315 H319 H335[1] |
| P-věty | P261 P264 P270 P271 P280 P301+310 P302+352 P304+340 P305+351+338 P312 P321 P330 P332+313 P337+313 P362 P403+233 P405 P501[1] |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
2-pyridon je organická sloučenina se vzorcem C5H4NH(O), za standardních podmínek bezbarvá pevná látka. Vytváří dimery spojené vodíkovými vazbami a existuje ve dvojici tautomerů.
Výskyt
Samotný 2-pyridon se v přírodě nevyskytuje, jeho deriváty byly ovšem identifikovány jako kofaktory v některých hydrogenázách.[2]
Příprava
Pomocí cyklizační reakce lze připravit 2-pyron, který se přemění na 2-pyridon reakcí s amoniakem:
Pyridin vytváří reakcemi s některými oxidačními činidly, jako je peroxid vodíku, N-oxid nazývaný pyridin-N-oxid; tato látka může za přítomnosti acetanhydridu podstoupit přesmyk na 2-pyridon:[3][4][5]
V Guareschiově-Thorpeově kondenzaci reaguje kyanoacetamid s 1,3-diketonem za vzniku 2-pyridonu.[6][7]
Reakci objevili Icilio Guareschi a Jocelyn Field Thorpe.[8][9]
Chemické vlastnosti
Tautomerie

Druhou tautomerní formou 2-pyridonu je 2-hydroxypyridin. Obdobná laktam-laktimová tautomerie se vyskytuje i u mnoha odvozených sloučenin.[10]
Tautomerie v pevném skupenství
Amidová skupina [vytváří vodíkové vazby s ostatními sloučeninami obsahujícími dusík a kyslík.
V pevném skupenství převažuje 2-pyridon, což bylo potvrzeno rentgenovou krystalografií, kde se ukázalo, že vodík se v pevném skupenství nachází blíže k dusíku než ke kyslíku (v důsledku nízké elektronové hustoty na vodíku je přesné určení obtížné), a infračervenou spektroskopií, kde byly patrné frekvence odpovídající vazbám C=O, zatímco frekvence příslušící vazbám O-H nebyly zaznamenány.[11][12][13][14]
Tautomerie v roztoku
Určení konkrétního tautomeru přítomného v roztoku bylo předmětem několika prací. Rozdíly v jejich energiích jsou velmi malé a vliv na ně má polarita rozpouštědla. V nepolárních rozpouštědlech převládá 2-hydroxypyridin, zatímco u polárních rozpouštědlech, jako jsou alkoholy a voda, je většinovou formou 2-pyridon.[10][15][16][17][18][19][20][21][22]
Rozdíl energií mezi oběma tautomery lze změřit infračervenou spektroskopií, v pevném skupenství činí 2,43 až 3,3 kJ/mol a v kapalném 8,95 kJ/mol a 8,83 kJ/mol.[23][24][25]
Tautomerizační mechanismus A
Jednomolekulární tautomerizace by probíhala přes zakázaný 1-3 suprafaciální přechodný stav a má tak vysokou energetickou bariéru, jejíž hodnota byla vypočítána metodami teoretické chemie na 125 nebo 210 kJ/mol. Přímá tautomerizace je energeticky nevýhodná; existuje zde několik jiných možných mechanismů.[25]
Dimerizace
2-pyridon a 2-hydroxypyridin mohou skrz dvojice vodíkových vazeb tvořit dimery.[26]
Shlukování v pevném skupenství
V pevném skupenství se dimer nevyskytuje; 2-pyridony zde zaujímají helikální strukturu vytvářenou vodíkovými vazbami. Některé substituované 2-pyridony, například 5-methyl-3-karbonitril-2-pyridon, vytváří v pevném skupenství dimery. Tyto struktury lze popsat s využitím rentgenové krystalografie. V pevné fázi se vodík nachází blíže ke kyslíku a název 2-pyridon je tak odpovídající.[10][11][12][13][14]
Shlukování v roztoku
V roztoku se vyskytuje dimerní forma; míra dimerizace závisí na polaritě rozpouštědla. Polární protická rozpouštědla interagují s vodíkovými vazbami, což vede k většímu podílu monomeru. Hydrofobní efekty nepolárních rozpouštědel způsobují převahu dimeru. Vlastnosti rozpouštědla ovlivňují také poměrné zastoupení tautomerů. V rovnovážné soustavě mohou být přítomny všechny možné kombinace tautomerů a dimerů, přesné určení všech rovnovážných konstant je tak obtížné.[26][6][7][8][9][27][28][29][2][30]
Analýza pomocí NMR spektroskopie je pomalá, provedení infračervené spektroskopie s vysokým rozlišením je v roztoku náročné a široké absorpční pásy v ultrafialové spektroskopii způsobují obtížné rozlišování tří nebo více podobných molekul.
Tautomerizační mechanismus B
Přímá tautomerizace je energeticky nevýhodná, dimerizace následovaná dvojitým přesunem protonu a disociace dimeru představuje autokatalytickou přeměnu jednoho tautomeru v druhý. Protická rozpouštědla mohou přenos protonu usnadňovat.
Katalytická aktivita
2-pyridon katalyzuje několik reakcí závislých na protonech, například aminolýzy esterů. V některých případech se používá kapalný 2-pyridon jako rozpouštědlo. Současný výzkum se zaměřuje na přesuny protonů z 2-pyridonu a jeho tautomeru s využitím izotopového značkování a kinetických a kvantově chemických metod; přitom se určuje krok určující rychlost reakce.[27][28][31]
Koordinační chemie
2-pyridon a některé jeho deriváty se používají jako ligandy v koordinační chemii, často jako 1,3-můstkové ligandy podobné karboxylátovým.[29]
V životním prostředí
2-pyridone je mikroorganismy v půdě rychle rozkládán, s poločasem kratším než týden.[30]
Bylo objeveno několik organismů schopných využívat 2-pyridon jako zdroj uhlíku, dusíku, a energie, jsou mezi nimi například grampozitivní bakterie Arthrobacter crystallopoietes[32] a některé aktinobakterie (Actinobacteria), které mohou pyridin a jeho jedno- či vícenásobně substituované alkyl-, karboxyl- a hydroxylderiváty. Rozklad 2-pyridonu je obvykle iniciován atakem monooxygenázy, čímž se vytváří diol, jako například 2,5-dihydroxypyridin, jenž je metabolizován v maleamátové dráze. Decyklizaci zprostředkovává enzym 2,5-dihydroxypyridinmonooxygenáza, který je také zapojen do metabolismu kyseliny nikotinové. U Arthrobacter crystallopoietes probíhá přinejmenším část rozkladu v plazmidech.[33]
Pyridindioly v roztocích mohou být přeměněny na barevné produkty; při rozkladu mnoha pyridinových rozpouštědel, jako jsou nesubstituovaný pyridin a pikoliny, byly pozorovány žluté pigmenty, příslušné metabolické dráhy často vedou k nadprodukci riboflavinu za přítomnosti těchto rozpouštědel.[34]
Rozklad pyridonů, dihydroxypyridinů a pyridinkarboxylových kyselin je často řízen oxygenázami, zatímco u pyridinových rozpouštědel obvykle tyto enzymy zapojeny nejsou a někdy dráha začíná redukčním krokem.[33]
Podobné pigmenty byly pozorovány při rozkladu chinolinů.[35]
Odkazy
Související články
- 2-pyron
- 4-pyridon
Externí odkazy
 Obrázky, zvuky či videa k tématu 2-pyridon na Wikimedia Commons
Obrázky, zvuky či videa k tématu 2-pyridon na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku 2-Pyridone na anglické Wikipedii.
- ↑ a b c d e f https://pubchem.ncbi.nlm.nih.gov/compound/8871
- ↑ a b Shima, S.; Lyon, E. J.; Sordel-Klippert, M.; Kauss, M.; Kahnt, J.; Thauer, R. K.; Steinbach, K.; Xie, X.; Verdier, L. and Griesinger, C., "Structure elucidation: The cofactor of the iron-sulfur cluster free hydrogenase Hmd: structure of the light-inactivation product", Angewandte Chemie International Edition, 2004, 43, 2547-2551
- ↑ Pyridin-N-oxydと酸無水物との反應. Yakugaku Zasshi. 1947, s. 51–52. DOI 10.1248/yakushi1947.67.3-4_51.
- ↑ Eiji Ochiai. Recent Japanese Work on the Chemistry of Pyridine 1-Oxide and Related Compounds. The Journal of Organic Chemistry. 1953, s. 534–551. DOI 10.1021/jo01133a010.
- ↑ V. Boekelheide; W. L. Lehn. The Rearrangement of Substituted Pyridine N-Oxides with Acetic Anhydride1.2. The Journal of Organic Chemistry. 1961, s. 428–430. DOI 10.1021/jo01061a037.
- ↑ a b Gilchrist, T.L. (1997). Heterocyclic Chemistry ISBN 0-470-20481-8
- ↑ a b V. R. Rybakov; A. A. Bush; E. B. Babaev; L. A. Aslanov. 3-Cyano-4,6-dimethyl-2-pyridone (Guareschi Pyridone). Acta Crystallographica E. 2004, s. o160–o161. DOI 10.1107/S1600536803029295.
- ↑ a b I. Guareschi. Mem. Reale Accad. Sci. Torino II.Chybí název periodika! 1896.
- ↑ a b H. Baron; F. G. P. Remfry; J. F. Thorpe. CLXXV.-The formation and reactions of imino-compounds. Part I. Condensation of ethyl cyanoacetate with its sodium derivative. Journal of the Chemical Society. 1904, s. 1726–1761. Dostupné online. DOI 10.1039/ct9048501726.
- ↑ a b c Forlani L.; CRISTONI G.; BOGA C.; TODESCO P. E.; DEL VECCHIO E.; SELVA S.; MONARI M. Reinvestigation of tautomerism of some substituted 2-hydroxypyridines. Arkivoc. 2002, s. 198–215. Dostupné online. DOI 10.3998/ark.5550190.0003.b18. (anglicky)[nedostupný zdroj]
- ↑ a b H. W. Yang; B. M. Craven. Charge Density of 2-Pyridone. Acta Crystallographica B. 1998, s. 912–920. DOI 10.1107/S0108768198006545. PMID 9880899.
- ↑ a b B. R. Penfold. The Electron Distribution in Crystalline Alpha Pyridone. Acta Crystallographica. 1953, s. 591–600. DOI 10.1107/S0365110X5300168X.
- ↑ a b U. Ohms; H. Guth; E. Heller; H. Dannöhl; A. Schweig. Comparison of Observed and Calculated Electron-Density 2-Pyridone, C5H5NO, Crystal-Structure Refinements at 295K and 120K, Experimental and Theoretical Deformation Density Studies. Zeitschrift für Kristallographie. 1984, s. 185–200. DOI 10.1524/zkri.1984.169.14.185.
- ↑ a b J. Almlöf; A. Kvick; I. Olovsson. Hydrogen Bond Studies Crystal Structure of Intermolecular Complex 2-Pyridone-6-Chloro-2-Hdroxypyridine. Acta Crystallographica B. 1971, s. 1201–1208. DOI 10.1107/S0567740871003753.
- ↑ Vögeli U.; VON PHILIPSBORN W. C-13 and H-1 NMR Spectroscopie Studies on Structure of N-Methyle-3-Pyridone and 3-Hydroypyridine. Organic Magnetic Resonance. 1973, s. 551–559. DOI 10.1002/mrc.1270051202. (anglicky)
- ↑ Specker H.; GAWROSCH H. Ultraviolet absorption of benztriaxole, pryridone and its salts. Chemische Berichte. 1942, s. 1338–1348. DOI 10.1002/cber.19420751115. (anglicky)
- ↑ Leis D. G.; CURRAN B. C. Electric Moments of Some Gamma-Substituted Pyridines. Journal of the American Chemical Society. 1945, s. 79–81. DOI 10.1021/ja01217a028. (anglicky)
- ↑ Albert A.; PHILLIPS J. N. Ionisation Constants of Heterocyclic Substances Hydroxy-Derivates of Nitrogenous Six-Membered Ring-Compounds. Journal of the Chemical Society. 1956, s. 1294–1304. DOI 10.1039/jr9560001294. (anglicky)
- ↑ Cox R. H.; BOTHNER-BY A. A. Proton Magnetic Resonance Spectra of Tautomeric Substituted Pyridines and Their Conjugated Acides. J. Phys. Chem.. 1969, s. 2465–2468. DOI 10.1021/j100842a001. (anglicky)
- ↑ Aksnes DW, Kryvi; KRYVI, Håkon; SAMUELSON, Olof; SJÖSTRAND, Elisabeth; SVENSSON, Sigfrid. Substituent and Solvent Effects in Proton Magnetic -Resonance (PMR) Spectra of 6 2-Substituted Pyridines. Acta Chem. Scand.. 1972, s. 2255–2266. DOI 10.3891/acta.chem.scand.26-2255. (anglicky)
- ↑ Aue DH, Betowski LD, Davidson WR, Bower MT, Beak P. Gas-Phase Basicities of Amides and Imidates - Estimation of Protomeric Equilibrium-Constantes by the Basicity methode in the Gas-Phase. Journal of the American Chemical Society. 1979, s. 1361–1368. DOI 10.1021/ja00500a001. (anglicky)
- ↑ Frank J., Alan R. Katritzky. Tautomeric pyridines. XV. Pyridone-hydroxypyridine equilibria in solvents of different polarity. J Chem Soc Perkin Trans 2. 1976, s. 1428–1431. DOI 10.1039/p29760001428. (anglicky)
- ↑ R. S. Brown; A. Tse; J. C. Vederas. Photoelectro-Determined Core Binding Energies and Predicted Gas-Phase Basicities for the 2-Hydroxypyridine 2-Pyridone System. Journal of the American Chemical Society. 1980, s. 1174–1176. DOI 10.1021/ja00523a050.
- ↑ P. Beak. Energies and Alkylation of Tautomeric Heterocyclic-Compounds - Old Problems New Answers. Accounts of Chemical Research. 1977, s. 186–192. DOI 10.1021/ar50113a006.
- ↑ a b H. I. Abdulla; M. F. El-Bermani. Infrared studies of tautomerism in 2-hydroxypyridine 2-thiopyridine and 2-aminopyridine. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2001, s. 2659–2671. DOI 10.1016/S1386-1425(01)00455-3. PMID 11765793. Bibcode 2001AcSpA..57.2659A.
- ↑ a b G. G. Hammes; P. J. Lillford. A Kinetic and Equilibrium Study of Hydrogen Bond Dimerization of 2-Pyridone in Hydrogen Bonding Solvent. Journal of the American Chemical Society. 1970, s. 7578–7585. DOI 10.1021/ja00729a012.
- ↑ a b C. B. Fischer; H. Steininger; D. S. Stephenson; H. Zipse. Catalysis of Aminolysis of 4-Nitrophenyl Acetate by 2-Pyridone. Journal for Physical Organic Chemistry. 2005, s. 901–907. DOI 10.1002/poc.914.
- ↑ a b L.-H. Wang; H. Zipse. Bifunctional Catalysis of Ester Aminolysis - A Computational and Experimental Study. Justus Liebigs Annalen der Chemie. 1996, s. 1501–1509. DOI 10.1002/jlac.199619961003.
- ↑ a b J. M. Rawson; R. E. P. Zipse. The coordination chemistry of 2-pyridones and its derivatives. Coordination Chemistry Reviews. 1995, s. 313–374. DOI 10.1016/0010-8545(94)01117-T.
- ↑ a b Gerald K. Sims. Degradation of Pyridine Derivatives in Soil. Journal of Environmental Quality. 1985, s. 580–584. Dostupné online. DOI 10.2134/jeq1985.00472425001400040022x.
- ↑ C. B. Fischer; K. Polborn; H. Steininger; H. Zipse. Synthesis and Solid-State Structures of Alkyl-Substituted 3-Cyano-2-pyridones. Zeitschrift für Naturforschung. 2004, s. 1121–1131. Dostupné online. DOI 10.1515/znb-2004-1008. Archivováno 30. 10. 2008 na Wayback Machine.
- ↑ Jerald C. Ensign; Sydney C. Rittenberg. A crystalline pigment produced from 2-hydroxypyridine by arthrobacter crystallopoietes n.sp. Archiv für Mikrobiologie. 1963, s. 137–153. DOI 10.1007/BF00422519. PMID 14106078.
- ↑ a b G. K. Sims; E. J. O'Loughlin; Ronald Crawford. Degradation of pyridines in the environment. CRC Critical Reviews in Environmental Control. 1989, s. 309–340. Dostupné online. DOI 10.1080/10643388909388372.
- ↑ Gerald K. Sims. Riboflavin Production during Growth of Micrococcus luteus on Pyridine. Applied and Environmental Microbiology. 1992, s. 3423–3425. DOI 10.1128/AEM.58.10.3423-3425.1992. PMID 16348793.
- ↑ E. J. O'Loughlin; S. Kehrmeyer; G. Sims. Isolation, characterization, and substrate utilization of a quinoline-degrading bacterium. International Biodeterioration & Biodegradation. 1996, s. 107–118. DOI 10.1016/S0964-8305(96)00032-7.
- Engdahl K.; AHLBERG P. Journal of Chemical Research. 1977, s. 340–341. (anglicky)
- Bensaude O., Chevrier M., Dubois J. Lactim-Lactam Tautomeric Equilibrium of 2-Hydroxypyridines. 1.Cation Binding, Dimerization and Interconversion Mechanism in Aprotic Solvents. A Spectroscopic and Temperature-Jump Kinetic Study. Journal of the American Chemical Society. 1978, s. 7055–7066. DOI 10.1021/ja00490a046. (anglicky)
- Bensaude O, Dreyfus G, Dodin G, Dubois J. Intramolecular Nondissociative Proton Transfer in Aqueous Solutions of Tautomeric Heterocycles: a Temperature-Jump Kinetic Study. Journal of the American Chemical Society. 1977, s. 4438–4446. DOI 10.1021/ja00455a037. (anglicky)
- Bensaude O, Chevrier M, Dubois J. Influence of Hydration upon Tautomeric Equilibrium. Tetrahedron Letters. 1978, s. 2221–2224. DOI 10.1016/S0040-4039(01)86850-7. (anglicky)
- Hammes GG, Park AC. Kinetic and Thermodynamic Studies of Hydrogen Bonding. Journal of the American Chemical Society. 1969, s. 956–961. DOI 10.1021/ja01032a028. (anglicky)
- Hammes GG, Spivey HO. A Kinetic Study of the Hydrogen-Bond Dimerization of 2-Pyridone. Journal of the American Chemical Society. 1966, s. 1621–1625. DOI 10.1021/ja00960a006. PMID 5942979. (anglicky)
- Beak P, Covington JB, Smith SG. Structural Studies of Tautomeric Systems: the Importance of Association for 2-Hydroxypyridine-2-Pyridone and 2-Mercaptopyridine-2-Thiopyridone. Journal of the American Chemical Society. 1976, s. 8284–8286. DOI 10.1021/ja00441a079. (anglicky)
- Beak P, Covington JB, White JM. Quantitave Model of Solvent Effects on Hydroxypyridine-Pyridone and Mercaptopyridine-Thiopyridone Equilibria: Correlation with Reaction-Field and Hydrogen-Bond Effects. The Journal of Organic Chemistry. 1980, s. 1347–1353. DOI 10.1021/jo01296a001. (anglicky)
- Beak P, Covington JB, Smith SG, White JM, Zeigler JM. Displacement of Protomeric Equilibria by Self-Association: Hydroxypyridine-Pyridone and Mercaptopyridine-Thiopyridone Isomer Pairs. The Journal of Organic Chemistry. 1980, s. 1354–1362. DOI 10.1021/jo01296a002. (anglicky)
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
chemical structure of 2-pyridone showing its tautomerization
chemical structure of 2-pyridone synthesis reaction
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the 2-pyridone molecule, a compound used in peptide synthesis. This image shows the lactim form.
Used colors:
- Uhlík, C: černá
- Vodík, H: bílá
- Kyslík, O: červená
- Nitrogen, N: blue
Chemical diagram showing the formation of 2-pyridone from 5-oxo-2-pentenoic acid
chemical structure of 2-pyridone tautomerizing dimer
chemical structure of 2-pyridone













