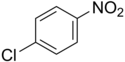
4-nitrochlorbenzen
| 4-nitrochlorbenzen | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 1-chlor-4-nitrobenzen |
| Anglický název | 4-nitrochlorobenzene |
| Sumární vzorec | C6H4ClNO2 |
| Vzhled | světle žlutá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 100-00-5 |
| PubChem | 7474 |
| SMILES | C1=CC(=CC=C1[N+](=O)[O-])Cl |
| InChI | InChI=1/C6H4ClNO2/c7-5-1-3-6(4-2-5)8(9)10/h1-4H |
| Vlastnosti | |
| Molární hmotnost | 157,55 g/mol |
| Teplota tání | 83,6 °C (356,8 K) |
| Teplota varu | 242,0 °C (515,2 K) |
| Hustota | 1,52 g/cm3 (20 °C) |
| Index lomu | 1,5857 (60 °C) |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu a horkém ethanolu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru a toluenu |
| Tlak páry | 27 Pa (30 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Teplota vzplanutí | 12 °C (285 K) |
Některá data mohou pocházet z datové položky. | |
4-nitrochlorbenzen (systematický název 1-chlor-4-nitrobenzen) je organická sloučenina používaná jako surovina při výrobě řady průmyslově využívaných sloučenin jako jsou antioxidanty v kaučuku. Je izomerní s 2-nitrochlorbenzenem a 3-nitrochlorbenzenem.
Výroba
4-nitrochlorbenzen se průmyslově vyrábí nitrací chlorbenzenu:[2]
Touto reakcí vznikají 2-nitroizomer a 4-nitroizomer v poměru 1:2, které se oddělí destilací. 4-nitrochlorbenzen byl původně získán nitrací 4-bromchlorobenzenu.[3]
Použití
4-nitrochlorbenzen je meziproduktem při výrobě mnoha dalších látek. Nitrací z něj vzniká 2,4-dinitrochlorbenzen a 1,2-dichlor-4-nitrobenzen. Redukcí kovovým železem vzniká 4-chloranilin. Díky přítomnosti nitroskupiny je benzenové jádro (na rozdíl od podobného chlorbenzenu) náchylné k nukleofilní aromatické substituci. Silně nukleofilní sloučeniny jako například hydroxidy, methoxidy a anorganické amidy nahrazují atom chloru jinými funkčními skupinami, přičemž se utváří 4-nitrofenol, 4-nitroanisol respektive 4-nitroanilin.[2]
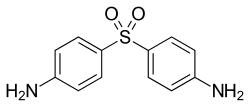
Dalším významným způsobem použití 4-nitrochlorbenzenu je jeho kondenzace s anilinem za vzniku 4-nitrodifenylaminu. Redukční alkylací nitroskupin vznikají sekundární arylaminy používané jako antioxidanty v kaučuku.
.
Reference
V tomto článku byl použit překlad textu z článku 4-Nitrochlorobenzene na anglické Wikipedii.
- ↑ a b 1-Chloro-4-nitrobenzene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b Gerald Booth "Nitro Compounds, Aromatic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim, 2005.
- ↑ "The nitration of mixed dihalogen benzenes" Recueil des Travaux Chimiques des Pays-Bas et de la Belgique. Amsterdam, 1915; pp. 204-235.
Externí odkazy
 Obrázky, zvuky či videa k tématu 4-nitrochlorbenzen na Wikimedia Commons
Obrázky, zvuky či videa k tématu 4-nitrochlorbenzen na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Chemical structure of 4-Nitrochlorobenzene; 4-Chloro-1-nitrobenzene; 4-Chloronitrobenzene; p-Nitrochlorobenzene; PNCBO
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the 4-nitrochlorobenzene molecule, an intermediate in the synthesis of other compounds.
Used colors:
- Uhlík, C: černá
- Vodík, H: bílá
- Kyslík, O: červená
- Nitrogen, N: blue
- Chlor, Cl: zelená