Acetylaceton
| Acetylaceton | |
|---|---|
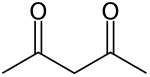 strukturní vzorec | |
 model molekuly (enolforma) | |
 model molekuly (ketoforma) | |
| Obecné | |
| Systematický název | pentan-2,4-dion |
| Anglický název | acetylacetone |
| Německý název | Acetylaceton |
| Funkční vzorec | CH3COCH2COCH3 (keto forma) |
| Sumární vzorec | C5H8O2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 123-54-6 |
| SMILES | O=C(C)CC(=O)C CC(=O)CC(=O)C |
| InChI | 1S/C5H8O2/c1-4(6)3-5(2)7/h3H2,1-2H3 |
| Vlastnosti | |
| Molární hmotnost | 100,12 g/mol |
| Teplota tání | −23 °C (250 K) |
| Teplota varu | 140 °C (413 K) |
| Hustota | 0,975 g/cm3 |
| Rozpustnost ve vodě | 16 g/100 ml |
| Měrná magnetická susceptibilita | 5,48×105 μm3/g |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H226 H302 H311 H331 |
| P-věty | P210 P261 P271 P280 P301+312 P302+352 P303+361+353 P304+340 P304+340 P403+233 |
| R-věty | R10 R22 |
| S-věty | S2 S21 S23 S24/25 |
| NFPA 704 | |
| Teplota vzplanutí | 34 °C |
| Teplota vznícení | 340 °C |
| Meze výbušnosti | 2,4 %-11,6 % |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Acetylaceton (systematický název pentan-2,4-dion) je organická sloučenina, která vytváří dva tautomery. Ketoforma má vzorec CH3COCH2COCH3.
Přestože je sloučenina nazvána podle diketonové formy, enolová forma je významnou složkou látky[2] a v mnoha rozpouštědlech převažuje.
Tato látka je prekurzorem acetylacetonátu (acac), běžného bidentátního ligandu. Je také základem pro syntézu heterocyklických sloučenin.
Vlastnosti
Tautomerie
Keto- a enolforma existují společně; jedná se o tautomery. Enolforma má symetrii C2v, což znamená, že vodíkový atom je rovnoměrně sdílen mezi oběma kyslíkovými atomy.[3] V plynném skupenství je rovnovážná konstanta Kketo→enol 11,7 (ve prospěch enolformy). Oba tautomery se dají snadno rozlišit pomocí NMR spektroskopie, infračervené spektroskopie a dalších metod.[4][5]
| Rozpouštědlo | Kketo→enol |
|---|---|
| Plynné skupenství | 11,7 |
| Cyklohexan | 42 |
| Toluen | 10 |
| THF | 7,2 |
| DMSO | 2 |
| Voda | 0,23 |
Rovnovážná konstanta je vysoká v nepolárních rozpouštědlech; ketoforma má větší zastoupení v polárních rozpouštědlech s přítomností vodíkových vazeb, například ve vodě.[6]
Kyselost/zásaditost
Acetylaceton je slabá kyselina:
| rozpouštědlo | T/°C | pKa[7] |
|---|---|---|
| 40% ethanol/voda | 30 | 9,8 |
| 70% 1,4-dioxan/voda | 28 | 12,5 |
| 80% DMSO/voda | 25 | 10,16 |
| DMSO | 25 | 13,41 |
| voda | 25 | 8,99±0,04 |
Velmi silné zásady, například organolithné sloučeniny, způsobují dvojnásobnou deprotonaci acetylacetonu. Vzniklé produkty mohou být alkylovány.
Příprava a výroba
Acetylaceton se průmyslově vyrábí tepelným přesmykem isopropenylacetátu[8]: CH2=C(CH3)OC(O)CH3 → CH3C(O)CH2C(O)CH3
Metody laboratorní přípravy začínají acetonem. Prvním způsobem je reakce acetonu s acetanhydridem za přítomnosti BF3 jako katalyzátoru:
(CH3CO)2O + CH3C(O)CH3 → CH3C(O)CH2C(O)CH3
Druhý způsob spočívá v kondenzaci acetonu a ethylacetátu následované reakcí s kyselinou:
NaOEt + EtO2CCH3 + CH3C(O)CH3 → NaCH3C(O)CHC(O)CH3 + 2 EtOH NaCH3C(O)CHC(O)CH3 + HCl → CH3C(O)CH2C(O)CH3 + NaCl
Díky jednoduchosti uvedených postupů je známo mnoho acetylacetonátů, tedy solí a esterů acetylacetonu, například C6H5C(O)CH2C(O)C6H5 (dbaH) a (CH3)3CC(O)CH2C(O)CC(CH3)3.
Reakce
Kondenzace
Acetylaceton je všestranným prekurzorem heterocyklických sloučenin, jelikož obě ketoskupiny mohou podstoupit kondenzační reakce. Reakcí s hydrazinem vznikají pyrazoly, s močovinou pyrimidiny.
Koordinační chemie
Acetylacetonátový aniont, acac−, vytváří komplexy s mnoha ionty přechodných kovů. Hlavním způsobem jejich přípravy je reakce příslušného iontu s acetylacetonem za přítomnosti zásady (B):
MBz + z Hacac ⇌ M(acac)z + z BH Zásada umožňuje odstranění protonů z acetylacetonu a posouvá rovnováhu reakce ve prospěch komplexu. Oba kyslíkové atomy se naváží na kov za vzniku šestičlenného chelátového kruhu. V některých případech je chelatační efekt tak silný, že k tvorbě komplexu není třeba přítomnost zásady. Jelikož takový komplex nemá elektrický náboj, je nerozpustný ve vodě ale rozpustný v nepolárních organických rozpouštědlech.
Biologická rozložitelnost
Acetylaceton se rozkládá působením enzymu acetylacetondioxygenázy, který štěpí vazbu C-C v molekule za vzniku acetátu a 2-oxopropanalu. Enzym k činnosti potřebuje železnaté nebo zinečnaté kationty, které slouží jako prostetická skupina. Biologický rozklad acetylacetonu byl pozorován u bakterie Acinetobacter johnsonii.[9]
C5H8O2 + O2 → C2H4O2 + C3H4O2
Reference
V tomto článku byl použit překlad textu z článku Acetylacetone na anglické Wikipedii.
- ↑ a b Acetylacetone. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ O'BRIEN, Brian. Co(tfa)3 & Co(acac)3 handout [online]. Gustavus Adolphus College. Dostupné online. (anglicky)
- ↑ CAMINATI, W.; GRABOW, J.-U. The C2v Structure of Enolic Acetylacetone. Journal of the American Chemical Society. 2006, roč. 128, čís. 3, s. 854–857. DOI 10.1021/ja055333g. PMID 16417375. (anglicky)
- ↑ MANBECK, Kimberly A.; BOAZ, Nicholas C.; BAIR, Nathaniel C.; SANDERS, Allix M. S. Substituent Effects on Keto–Enol Equilibria Using NMR Spectroscopy. Journal of Chemical Education. 2011, roč. 88, čís. 10, s. 1444–1445. Dostupné online. DOI 10.1021/ed1010932. (anglicky)
- ↑ YOSHIDA, Z.; OGOSHI, H.; TOKUMITSU, T. Intramolecular hydrogen bond in enol form of 3-substituted-2,4-pentanedione. Tetrahedron. 1970, roč. 26, s. 5691–5697. Dostupné online. DOI 10.1016/0040-4020(70)80005-9. (anglicky)
- ↑ REICHARDT, Christian. Solvents and Solvent Effects in Organic Chemistry. [s.l.]: Wiley-VCH, 2003. ISBN 3-527-30618-8.
- ↑ IUPAC SC-Database Archivováno 19. 6. 2017 na Wayback Machine. A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- ↑ SIEGEL, Hardo; EGGERSDORFER, Manfred. Ullmann's Encyclopedia of Industrial Chemistry. Ketones. Weinheim: Wiley-VCH, 2002. DOI 10.1002/14356007.a15_077. (anglicky)
- ↑ STRAGANZ, G.D.; GLIEDER, A.; BRECKER, L.; RIBBONS, D.W. Acetylacetone-cleaving enzyme Dke1: a novel C–C-bond-cleaving enzyme from Acinetobacter johnsonii. Biochem. J.. 2003, roč. 369, čís. 3, s. 573–581. DOI 10.1042/BJ20021047. PMID 12379146. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Acetylaceton na Wikimedia Commons
Obrázky, zvuky či videa k tématu Acetylaceton na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
نموذج الكرة والعصا لمعقّد VO(O2C5H7)2.
acetyloaceton
Keto-enol equilibrium of acetylacetone. Created with ChemDoodle and Adobe Illustrator CC 2017.












