Acetylidy
Acetylidy jsou organické sloučeniny s obecnými vzorci MC≡CH a MC≡CM, kde M je atom kovu.[1] Toto označení se také používá pro substituované acetylidy, RC≡CM, kde R je organická funkční skupina.
Acetylidy se používají jako reaktanty v organické syntéze.
Nejvýznamnější sloučeninou z této skupiny je acetylid vápenatý, obvykle nazývaný karbid vápenatý.
Struktura
Acetylidy alkalických kovů a kovů alkalických zemin s obecným vzorcem MC≡CM jsou sloučeniny podobné solím, jež obsahují ionty C 2−
2 . Jejich iontová povaha se projevuje snadnou hydrolýzou na acetylen a oxidy kovů; ionty C 2−
2 jsou také rozpustné v kapalném amoniaku.[3]
Základní stav C 2−
2 má uzavřenou elektronovou slupku 1Σ +
g , v důsledku čehož je izoelektronický s neutrální molekulou N2,[4] který jej částečně stabilizuje.
Podobné acetylidy jiných, hlavně přechodných, kovů (například acetylid stříbrný a měďný) jsou kovalentní a acetylidové ionty jsou na kovy navázané pevně, což se projevuje na jejich stabilitě vůči vodě a odlišnými chemickými vlastnostmi.
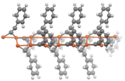
Acetylidy druhu RC≡CM (R = H nebo alkyl) mívají podobné vlastnosti jako příslušné dvojnásobně substituované sloučeniny. Za nepřítomnosti dalších ligandů vykazují tyto acetylidy polymerní struktury, ve kterých jsou acetylidové skupiny můstkovými ligandy.

Příprava
Koncové alkyny jsou slabými kyselinami:[6]
- RC≡CH + R″M ⇌ R″H + RC≡CM
K přípravě acetylidů z acetylenu a dalších alkynů se používají organokovové[7] nebo anorganické superzásady[8] v rozpouštědlech méně kyselých než příslušný alkyn. Původně byl používán kapalný amoniak, ovšem běžnější jsou ethery.
Amid lithný,[6] bis(trimethylsilyl)amid lithný[9] a organolithné sloučeniny, jako například butyllithium,[7] lze použít na tvorbu lithných acetylidů:
Sodné a draselné acetylidy se dají získat z mnoha různých anorganických sloučenin, například amidu sodného[8] nebo z kovů, často i za pokojové teploty a atmosférického tlaku.[6]
Acetylid měďný je možné připravit průchodem acetylenu vodným roztokem chloridu měďného, protože má tato sloučenina nízký součin rozpustnosti.[6] Podobným způsobem lze z dusičnanu stříbrného vytvořit acetylid stříbrný.
Acetylid vápenatý se vyrábí reakcí uhlíku s oxidem vápenatým při teplotě okolo 2 000 °C., podobně probíhá i výroba acetylidu lithného.
Reakce a použití
Acetylidy typu RC2M se používají v alkynylačních reakcích jako nukleofily, které se navazují na elektrofilní a nenasycené substráty; příkladem využití je Favorského reakce.
Ethylpropiolát je deprotonován n-butyllithem na acetylid. Tento acetylid se aduje na karbonylovou skupinu cyklopentanonu. Hydrolýzou poté vznikne alkynylalkohol.[10]

Párovací reakce
Acetylidy jsou reaktivními meziprodukty některých párovacích reakcí, například Sonogaširovy, Cadiotovy–Chodkiewiczovy, Glaserovy a Eglintonovy.
Bezpečnost
Některé acetylidy jsou výbušné.[11]
Příprava acetylidů může být nebezpečná kvůli nakládání s plynným acetylenem za přítomnosti kovů, jako jsou rtuť, stříbro či měď, nebo slitin, které je obsahují (mosazi, bronzu, stříbrné pájky).
Odkazy
Související články
- Ethynyl
- Ethynylový radikál
- Diuhlík
- Acetylendiol
Externí odkazy
 Obrázky, zvuky či videa k tématu Acetylidy na Wikimedia Commons
Obrázky, zvuky či videa k tématu Acetylidy na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Acetylide na anglické Wikipedii.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.a00067. (anglicky) DOI: 10.1351/goldbook.
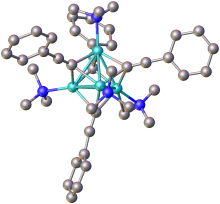
- ↑ Bernd Schubert; Erwin Weiss. (PHCCLi)4(tmhda)2, A Polymeric Organolithium Compound with Cubic Li4C4 Structural Units. Angewandte Chemie International Edition in English. 1983, s. 496–497. DOI 10.1002/anie.198304961.
- ↑ Markus Hamberger; Stefan Liebig; Ute Friedrich; Nikolaus Korber; Uwe Ruschewitz. Evidence of Solubility of the Acetylide Ion C 2−
2 : Syntheses and Crystal Structures of K2C2·2 NH3, Rb2C2·2 NH3, and Cs2C2·7 NH3. Angewandte Chemie International Edition. 2012-12-21, s. 13006–13010. DOI 10.1002/anie.201206349. PMID 23161511. - ↑ T. Sommerfeld; U. Riss; H.-D. Meyer; L. Cederbaum. Metastable C 2−
2 dianion. Physical Review Letters. 1997, s. 1237–1240. DOI 10.1103/PhysRevLett.79.1237. Bibcode 1997PhRvL..79.1237S. - ↑ Stephen S. Y. Chui; Miro F. Y. Ng; Chi-Ming Che. Structure Determination of Homoleptic AuI, AgI, and CuI Aryl/Alkylethynyl Coordination Polymers by X-ray Powder Diffraction. Chemistry: A European Journal. 2005, s. 1739–1749. DOI 10.1002/chem.200400881. PMID 15669067.
- ↑ a b c d Heinz Günter Viehe. Chemistry of Acetylenes. Angewandte Chemie. 1969, s. 170–179 & 225–241. Dostupné online. DOI 10.1002/ange.19720840843.
- ↑ a b M. M. Midland; J. I. McLoughlin; T. Ralph. Preparation and Use of Lithium Acetylide: 1-Methyl-2-ethynyl-endo-3,3-dimethyl-2-norbornanol. Organic Syntheses. 1990, s. 14. DOI 10.15227/orgsyn.068.0014.
- ↑ a b Donald D. Coffman. Dimethylethhynylcarbinol. Organic Syntheses. 1940, s. 20. DOI 10.15227/orgsyn.020.0040.
- ↑ Melanie Reich. Addition of a lithium acetylide to an aldehyde; 1-(2-pentyn-4-ol)-cyclopent-2-en-1-ol. ChemSpider Synthetic Pages. 2001-08-24, s. 137. DOI 10.1039/SP137.
- ↑ M. Mark Midland; Alfonso Tramontano; John R. Cable. Synthesis of alkyl 4-hydroxy-2-alkynoates. The Journal of Organic Chemistry. 1980, s. 28–29. DOI 10.1021/jo01289a006.
- ↑ Franco Cataldo; Carlo S. Casari. Synthesis, Structure and Thermal Properties of Copper and Silver Polyynides and Acetylides. Journal of Inorganic and Organometallic Polymers and Materials. 2007, s. 641–651. ISSN 1574-1443. DOI 10.1007/s10904-007-9150-3.
Média použitá na této stránce
structure of PhC2Li complexed to N,N,N',N'-tetramethyl-1,6-diaminohexane per doi 10.1002/anie.198304961
Autor: V8rik na projektu Wikipedie v jazyce angličtina, Licence: CC BY 3.0
Acetylide to carbonyl addition