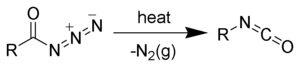Acylazidy

Acylazidy jsou deriváty karboxylových kyselin s obecným vzorcem RCON3. Tyto sloučeniny, které jsou podtřídou organických azidů, jsou obecně bezbarvé.[1]
Příprava
Obvykle se acylazidy vytvářejí za podmínek, kdy přesmykují na isokyanáty.[1]
Alkyl nebo arylové acylchloridy reagují s azidem sodným za vzniku acylazidů.[2][3]
Acylazidy byly rovněž syntetizovány z různých karboxylových kyselin a azidu sodného za přítomnosti trifenylfosfinu a trichloroacetonitrilového katalyzátoru ve vynikajících výtěžcích za mírných podmínek.[4] Další způsob přípravy začíná reakcí alifatických a aromatických aldehydů s azidem jodným, který vzniká z azidu sodného a chloridu jodného v acetonitrilu.[5]
Využití
Při Curtiově přesmyku vznikají z acylazidů isokyanáty.[6][7]
Acylazidy vznikají také při Darapského degradaci.[8][9][10]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Acyl azide na anglické Wikipedii.
- ↑ a b LWOWSKI, Walter. Acyl azides. The Azido Group. DOI 10.1002/9780470771266.ch9.
- ↑ ALLEN, C. F. H.; BELL, Alan. UNDECYL ISOCYANATE. Organic Syntheses. S. 94. DOI 10.15227/orgsyn.024.0094.
- ↑ MUNCH-PETERSEN, Jon. m-Nitrobenzazide (Benzoyl azide, m-nitro-). Organic Syntheses. S. 53. DOI 10.15227/orgsyn.033.0053.
- ↑ JANG, Doo; KIM, Joong-Gon. Direct Synthesis of Acyl Azides from Carboxylic Acids by the Combination of Trichloroacetonitrile, Triphenylphosphine and Sodium Azide. Synlett. S. 2072–2074. DOI 10.1055/s-2008-1077979.
- ↑ MARINESCU, Lavinia; THINGGAARD, Jacob; THOMSEN, Ib B., Mikael Bols. Radical Azidonation of Aldehydes. J. Org. Chem.. S. 9453–9455. DOI 10.1021/jo035163v. PMID 14629171.
- ↑ SMITH, Peter A. S. The Curtius reaction. Organic Reactions. S. 337–449. DOI 10.1002/0471264180.or003.09.
- ↑ SCRIVEN, Eric F. V.; TURNBULL, Kenneth. Azides: their preparation and synthetic uses. Chemical Reviews. S. 297–368. DOI 10.1021/cr00084a001.
- ↑ GAGNON, Paul E.; BOIVIN, Paul A.; CRAIG, Hugh M. Synthesis of Amino Acids from Substituted Cyanoacetic Esters. Canadian Journal of Chemistry. S. 70–75. DOI 10.1139/v51-009.
- ↑ RODD, E. H. Chemistry of Carbon Compounds.Chybí název periodika! New York: S. 1157.
- ↑ GAGNON, Paul E.; NADEAU, Guy; CÔTÉ, Raymond. Synthesis of α-Amino Acids from Ethyl Cyanoacetate. Canadian Journal of Chemistry. S. 592–597. DOI 10.1139/v52-071.
Literatura
- CURTIUS, Theodor. Ueber Stickstoffwasserstoffsäure (Azoimid) N3H. Chemische Berichte. S. 3023–3033. DOI 10.1002/cber.189002302232. (německy)
- CURTIUS, Theodor. 20. Hydrazide und Azide organischer Säuren I. Abhandlung. Journal für praktische Chemie. S. 275–294. DOI 10.1002/prac.18940500125. (německy)
- DARAPSKY, August. Darstellung von α-Aminosäuren aus Alkyl-cyanessigsäuren. Journal für praktische Chemie. S. 250–267. DOI 10.1002/prac.19361460806. (německy)
- DARAPSKY, August; HILLERS, Dietrich. Über das Hydrazid der Cyanessigsäure, Isonitrosocyanessigsäure und Nitrocyanessigsäure. Journal für praktische Chemie. S. 297–341. DOI 10.1002/prac.19150920117. (německy)
Externí odkazy
 Obrázky, zvuky či videa k tématu Acylazidy na Wikimedia Commons
Obrázky, zvuky či videa k tématu Acylazidy na Wikimedia Commons
Média použitá na této stránce
Darapasky Degradation Correction
Description: Reaction scheme of the Curtius rearrangement.
- Author, date of creation: selfmade by ~K, 08 September 2005.
- Source: -
- Copyright: Public domain. (PD)
- Comments: high-resolution b/w PNG; ChemDraw / The GIMP.
Preparation of acyl azides from acyl chlorides
- C. F. H. Allen and Alan Bell. "Undecyl isocyanate". Org. Synth.; Coll. Vol. 3: 846.
- Jon Munch-Petersen (1963). "m-Nitrobenzazide". Org. Synth.; Coll. Vol. 4: 715.
Chemical diagram for a generic acyl azide