Adamantan
| Adamantan | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
vzorek adamantanu | |
| Obecné | |
| Systematický název | tricyklo[3.3.1.13,7]dekan |
| Sumární vzorec | C10H16 |
| Vzhled | bílý prášek[1] |
| Identifikace | |
| Registrační číslo CAS | 281-23-2 |
| EC-no (EINECS/ELINCS/NLP) | 206-001-4 |
| PubChem | 9238 |
| ChEBI | 40519 |
| SMILES | C1C3CC2CC(CC1C2)C3 |
| InChI | InChI=1S/C10H16/c1-7-2-9-4-8(1)5-10(3-7)6-9/h7-10H,1-6H2 |
| Vlastnosti | |
| Molární hmotnost | 136,23 g/mol |
| Teplota tání | 270 °C (543 K) |
| Hustota | 1,07 g/cm3[1] |
| Index lomu | 1,568 |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v uhlovodících |
| Tlak páry | 1,49 kPa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H319 H400[1] |
| P-věty | P264+265 P273 P280 P305+351+338 P337+317 P391 P501[1] |
Některá data mohou pocházet z datové položky. | |
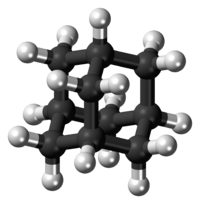
Adamantan je polycyklický uhlovodík se vzorcem (CH)4(CH2)6; jeho molekuly lze považovat za tři spojené cyklohexanové kruhy. Prostorové uspořádání atomů uhlíku je u něj stejné jako v krystalu diamantu; tato sloučenina je nejjednodušším zástupcem diamantoidů.
Deriváty adamantanu mají využití jako léčiva, polymery a teplotně stálá maziva.
Historie a příprava
V roce 1924 navrhl H. Decker existenci adamantanu, který tehdy nazval dekaterpen.[2]
Adamantan se poprvé podařilo izolovat z hodonínské ropy v Ústavu technologie paliv a svítiv a technologie vody na počátku 30. let 20. století (izolace prezentována na XII. sjezdu průmyslové chemie roku 1932 v Praze).[3] Jeho objevitelem je český chemik Stanislav Landa. Pokusy o umělou syntézu uspěly až o desetiletí později.
První pokus o jeho přípravu v laboratoři provedl roku 1924 Hans Meerwein prostřednictvím reakce formaldehydu a diethylmalonátu za přítomnosti piperidinu; místo adamantanu však získal 1,3,5,7-tetrakis(methoxykarbonyl)bicyklo[3.3.1]nonan-2,6-dion: tato sloučenina, později nazvaná Meerweinův ester, ale může být použita na přípravu adamantanu a jeho derivátů.[4] D. Bottger se pokusil o přípravu adamantanu z Meerweinova esteru, získal jeho derivát.[5]
Další pokusy byly založeny na floroglucinolu a derivátech cyklohexanonu, ale také neuspěly.[6]

První úspěšnou přípravu adamantanu předvedl Vladimir Prelog v roce 1941 s použitím Meerweinova esteru.[7][8] Výtěžnost této přípravy, složené z pěti kroků, byla 0,16 %, postup je tak prakticky nepoužitelný; lze však takto získat některé deriváty adamantanu.[6]

Prelogův postup byl v roce 1956 upraven; výtěžek dekarboxylace se podařilo zlepšit přidáním reakce Hunsdieckerových (11 %) a Hoffmanovy reakce (24 %), které zvýšily celkovou výtěžnost na 6,5 %.[9][10] Proces byl stále příliš složitý, v roce 1957 nalezl Paul von Ragué Schleyer vhodnější postup, kdy se nejprve hydrogenuje dicyklopentadien za přítomnosti katalyzátoru (například oxidu platiničitého) za tvorby tricyklodekanu a vzniklý produkt se poté působením Lewisovy kyseliny (například chloridu hlinitého) jako dalšího katalyzátoru převádí na adamantan. Takto lze získat adamantan s výtěžností 30–40 %; tento postup umožnil podrobnější zkoumání adamantanu a stále se používá v laboratořích.[11][12] Později se účinnost přípravy adamantanu podařilo navýšit na 60 %[13] a za působení ultrazvuku a katalýzy superkyselinami na 98 %.[14]

Výše uvedenými postupy vzniká adamantan jako polykrystalický prášek. Jednotlivé krystaly lze získat z jeho taveniny, roztoků i par. Nejhorší kvality se dosahuje u taveniny a nejlepší u roztoku, kde je ale krystalizace značně pomalá – k vytvoření 5–10mm krystalu je třeba několik měsíců; většinou se tak využívá plynné skupenství;[15] kde adamantan sublimuje v křemíkové trubici v peci vybavené zařízeními udržujícími určitý gradient teploty (kolem 10 °C/cm). Krystalizace začíná na jednom konci trubice, kde se udržuje teplota blízko teploty tuhnutí adamantanu. Při postupném ochlazování za zachování gradientu teplot se oblast tání posouvá (o přibližně 2 mm za hodinu) a vzniká monokrystal.[16]
Fyzikální vlastnosti
Čistý adamantan je bezbarvá krystalická pevná látka s kafrovou vůní. Ve vodě se nerozpouští, ale je rozpustný v nepolárních organických rozpouštědlech.
Struktura

Elektronovou difrakcí a rentgenovou krystalografií bylo zjištěno, že molekula adamantanu má symetrii typu Td. Délky vazeb uhlík–uhlík jsou 154 pm, téměř stejné jako u diamantu. Vzdálenosti mezi atomy uhlíku a vodíku činí 111,2 pm[17]
Za běžných podmínek krystalizuje adamantan v plošně centrované krychlové soustavě s prostorovou grupou Fm3m, a = 942,6 ± 0,8 pm, která obsahuje i molekuly s narušenou orientací. Tato struktura se může přeměňovat na uspořádanou primitivní čtverečnou (a = 664,1 pm, c = 887,5 pm), a to za teplot pod 208 K nebo tlaků nad 500 MPa.[6][18]
Tvrdost
Základní hodnoty tenzoru pružnosti, C11, pro krystalové směry <110>, <111>, a <100>, jsou postupně 7,52, 8,20, a 6,17 GPa;[16] u diamantu mají hodnoty 1161, 1174, a 1123 GPa.[19] Uspořádání atomů uhlíku je u adamantanu stejné jako u diamantu.[20] V případě adamantanu ovšem molekuly netvoří kovalentní mřížku, ale interagují slabými Van der Waalsovými silami, v důsledku čehož jsou krystaly adamantanu měkké a tvárné.[15][16][21]
Spektroskopie
NMR spektrum adamantanu obsahuje dva málo odlišené signály, které odpovídají místům 1 a 2 (viz obrázek níže). Chemické posuny při 1H-NMR jsou 1,873 a 1,756 ppm a u 13C-NMR 28,46 a 37,85 ppm.[22] Jednoduchý vzhled těchto spekter je v souladu s vysokou molekulovou symetrií.
Infračervené spektrum adamantanu obsahuje následující hlavní absorpční pásy:[17]
| Vlnočet, cm−1 | Odpovídající vibrace* |
|---|---|
| 444 | δ(CCC) |
| 638 | δ(CCC) |
| 798 | ν(C−C) |
| 970 | ρ(CH2), ν(C−C), δ(HCC) |
| 1103 | δ(HCC) |
| 1312 | ν(C−C), ω(CH2) |
| 1356 | δ(HCC), ω(CH2) |
| 1458 | δ(HCH) |
| 2850 | ν(C−H) v CH2 skupině |
| 2910 | ν(C−H) v CH2 skupině |
| 2930 | ν(C−H) v CH2 skupině |
* Typy vibrací: δ – deformační, ν – valenční, ρ a ω – deformační vibrace skupin CH2 vychylující je mimo rovinu
Optická aktivita
Deriváty adamantanu, které mají na každém uzlovém uhlíku jiný substituent, jsou chirální.[23] Tato aktivita byla popsána v roce 1969 u derivátu majícího jako substituenty vodík, brom, methylovou, a karboxylovou skupinu. Specifické rotace bývají nízké, obvykle do 1°.[24][25]
Názvosloví
Systematický název adamantanu je tricyklo[3.3.1.13,7]dekan; IUPAC ale doporučuje používání názvu "adamantan".[26]

Molekula adamantanu obsahuje pouze atomy uhlíku a vodíku a má symetrii typu Td. Polohu jeho 16 uhlíků a 10 vodíků tak lze popsat pomocí pouhých dvou míst, označovaných 1 (4 ekvivalentní místa) a 2 (6 ekvivalentních míst).
Podobnou strukturu nají noradamantan (obsahující o jednu skupinu CH2 méně) a homoadamantan (který má o jednu skupinu CH2 více).
Chemické vlastnosti
Tvorba kationtů
Adamantanový kation lze vytvořit reakcí 1-fluoradamantanu s fluoridem antimoničným; je poměrně stálý.[27][28]
Působením superkyselin lze vytvořit dikation 1,3-didehydroadamantanu. Tento kation je stabilizován „trojrozměrnou aromaticitou“[29] či homoaromaticitou.[30] Vzniklí tetracentrická dvouelektronová vazba je tvořena párem elektronu delokalizovaných na čtyřech atomech uhlíku.

Reakce
Většina reakcí adamantanu probíhá na trikoordinovaných uhlících.
Působením koncentrované kyseliny sírové vzniká adamantanon.[31]

Karbonylová skupina adamantanonu může vstupovat do dalších reakcí, kterými lze získat například adamantan-2-karbonitril[32] a 2-methyladamantan.[33]
Bromace
Adamantan snadno reaguje s bromačními činidly, například samotným bromem. Složení produktů závisí na podmínkách reakce, jako jsou přítomnost a druh katalyzátoru.[34]

Zahříváním směsi adamantanu a bromu se vytváří monosubstituovaná sloučenina adamantanu, 1-bromadamantan. Za přítomnosti Lewisovy kyseliny lze dosáhnout vícenásobné bromace.[35]
Lewisovy kyseliny bromaci urychlují, ozáření nebo přidání radikálů na její rychlost vliv nemá, což naznačuje, že reakce probíhá iontovým mechanismem.[6]
Fluorace
První fluorace adamantanu byly provedeny pomocí 1-hydroxyadamantanu[36] a 1-aminoadamantanu. Pozdější fluorace využívaly i samotný adamantan.[37] U všech výše uvedených reakcí byl meziproduktem adamantanový kation, který následně reagoval s fluorovanými nukleofily; byly ale popsány i fluorace plynným fluorem.[38]
Karboxylace
Karboxylací adamantanu kyselinou mravenčí vzniká kyselina 1-adamantankarboxylová.[39]

Oxidace
1-hydroxyadamantan lze získat hydrolýzou 1-bromadamantanu ve směsi vody a acetonu, případně ozonací adamantanu:[40] Oxidací uvedeného alkoholu vzniká adamantanon.

Ostatní
Nitrace adamantanu je obtížná.[41] Dusíkaté léčivo amantadin vzniká reakcí adamantanu s bromem nebo kyselinou dusičnou za vzniku sloučeniny s bromem nebo nitroesteovou skupinou v poloze 1. Reakcemi kterékoliv z těchto sloučenin s acetonitrilem se tvoří acetamid,který lze hydrolyzovat na 1-adamantylamin:[42]

Použití
Samotný adamantan, jako nefunkcionalizovaný uhlovodík, nemá širší využití. Využití má při suchém leptání[43] a úpravách polymerů.
U barvivových laserů může adamantan prodlužovat životnost aktivního prostředí; nemůže být fotoionizován, protože se jeho absorpční pásy nacházejí v oblasti vakuového ultrafialového záření.[44]
V lékařství
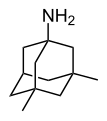
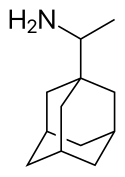
Některé deriváty adamantanu mají lékařská využití. Amantadin se v roce 1967 začal používat jako antivirotikum proti chřipce[45] a později také na léčbu Parkinsonovy nemoci.[46][47] K léčivům založeným na derivátech adamantanu patří také adapalen, adapromin, bromantan, karmantadin, chlodantan, dopamantin, memantin, rimantadin, saxagliptin, tromantadin, a vildagliptin. Polymery adamantanu mohou být použity proti HIV.[48]
Chřipkové viry si vyvinuly odolnost vůči amantadinu a rimantadinu, které od roku 2016 nejsou účinné proti převažujícím kmenům.
- Adapalen
- Adapromin
- Amantadin
- Bromantan
- Memantin
- Rimantadin
- Saxagliptin
- Tromantadin
- Vildagliptin
Palivo vesmírných lodí
Adamantan by mohl být používán jako hnací plyn ve vesmírných lodích, protože se snadno ionizuje, lze jej přechovávat v pevném stavu a nejsou tak potřeba vysokotlaké nádoby, a jeho toxicita je nízká.[49]
Ostatní
Klecovitá struktura pevného adamantanu umožňuje zachytávání různých molekul, které lze po narušení matrice uvolnit do lidského těla.[13][50]
Analogy adamantanu
Je známo mnoho dalších molekul se strukturou podobnou adamantanu, jako jsou oxid fosforitý (P4O6), oxid arsenitý (As4O6), oxid fosforečný (P4O10 = (PO)4O6), sulfid fosforečný (P4S10 = (PS)4S6), a hexamethylentetramin (C6N4H12 = N4(CH2)6).[51] Patří sem též tetramethylendisulfotetramin (zkráceně nazývaný „tetramin“), rodenticid, který je silně toxický pro člověka a ve většině zemí je tak zakázán. V roce 2005 byl získán křemíkový analog adamantanu, silaadamantan.[52]
Arsenicin A je přírodní organoarsenová sloučenina vyskytující se v mořských houbách druhu Echinochalina bargibanti; jedná se o první známý heterocyklus obsahující více než jeden atom arsenu.[53][54][55][56]
- Adamantan
- Hexamethylentetramin
- Oxid fosforečný
- Sulfid fosforečný
- Tetramethylendisulfotetramin
- Arsenicin A
Spojením více adamantanových jednotek do jednoho polycyklu vznikají vyšší diamantoidy, například diamantan (C14H20 – ze dvou adamantanů), triamantan (C18H24), tetramantan (C22H28), pentamantan (C26H32), a hexamantan (C26H30). Připravují se podobně jako adamantan, a také je lze izolovat z ropy, i když v mnohem menších množstvích.
Reference
V tomto článku byl použit překlad textu z článku Adamantane na anglické Wikipedii.
- ↑ a b c d e f https://pubchem.ncbi.nlm.nih.gov/compound/9238
- ↑ H. Decker. Versammlung deutscher Naturforscher und Ärzte. Angewandte Chemie. 1924, s. 795. doi:10.1002/ange.19240374102. Bibcode 1924AngCh..37..781..
- ↑ VÍCHA, Robert; POTÁČEK, Milan. Kde roste adamantan. Chemické listy. 2004, roč. 98, s. 68 – 74. Dostupné online [cit. 2023-12-14].
- ↑ RADCLIFFE, Marc D.; GUTIERREZ, Alberto; BLOUNT, John F.; MISLOW, Kurt. Structure of Meerwein's ester and of its benzene inclusion compound. Journal of the American Chemical Society. 1984, s. 682–687. Dostupné v archivu pořízeném z originálu dne 2011-08-09. doi:10.1021/ja00315a037.
- ↑ Coffey, S. and Rodd, S. (eds.) (1969) Chemistry of Carbon Compounds. Vol 2. Part C. Elsevier Publishing: New York.
- ↑ a b c d Fort, Raymond C.; SCHLEYERS, PAUL VON R. Adamantane: Consequences of Diamondoid Structure. Chemical Reviews. 1964, s. 277–300. doi:10.1021/cr60229a004.
- ↑ Prelog V., Seiwerth R. Über die Synthese des Adamantans. Chemische Berichte. 1941, s. 1644–1648. doi:10.1002/cber.19410741004.
- ↑ Prelog V., Seiwerth R. Über eine neue, ergiebigere Darstellung des Adamantans. Chemische Berichte. 1941, s. 1769–1772. doi:10.1002/cber.19410741109.
- ↑ STETTER, H.; BANDER, O.; NEUMANN, W. Über Verbindungen mit Urotropin-Struktur, VIII. Mitteil.: Neue Wege der Adamantan-Synthese. Chemische Berichte. 1956, s. 1922. doi:10.1002/cber.19560890820.
- ↑ MCKERVEY, M. Synthetic approaches to large diamondoid hydrocarbons. Tetrahedron. 1980, s. 971–992. doi:10.1016/0040-4020(80)80050-0.
- ↑ Schleyer, P. von R. A Simple Preparation of Adamantane. Journal of the American Chemical Society. 1957, s. 3292. doi:10.1021/ja01569a086.
- ↑ SCHLEYER, P. VON R.; DONALDSON, M. M.; NICHOLAS, R. D.; CUPAS, C. Adamantane. Org. Synth.. 1973.; Coll. Vol.. S. 16.
- ↑ a b G. Ali Mansoori. Molecular building blocks for nanotechnology: from diamondoids to nanoscale materials and applications. [s.l.]: Springer, 2007. ISBN 978-0-387-39937-9. S. 48–55.
- ↑ Steven V. Ley, Caroline M. R. Low. Ultrasound in Synthesis. [s.l.]: [s.n.]
- ↑ a b WINDSOR, C. G.; SAUNDERSON, D. H.; SHERWOOD, J. N.; TAYLOR, D.; PAWLEY, G. S. Lattice dynamics of adamantane in the disordered phase. Journal of Physics C: Solid State Physics. 1978, s. 1741–1759. doi:10.1088/0022-3719/11/9/013. Bibcode 1978JPhC...11.1741W.
- ↑ a b c DRABBLE, J. R.; HUSAIN, A. H. M. Elastic properties of adamantane single crystals. Journal of Physics C: Solid State Physics. 1980, s. 1377–1380. doi:10.1088/0022-3719/13/8/008. Bibcode 1980JPhC...13.1377D.
- ↑ a b Bagrii, E.I. Adamantanes: synthesis, properties, applications. [s.l.]: Nauka, 1989. Dostupné online. ISBN 5-02-001382-X. S. 5–57. (rusky)
- ↑ Vijayakumar, V. Pressure induced phase transitions and equation of state of adamantane. Journal of Physics: Condensed Matter. 2001, s. 1961–1972. doi:10.1088/0953-8984/13/9/318. Bibcode 2001JPCM...13.1961V.
- ↑ Anastassakis, E.; SIAKAVELLAS, M. Elastic and Lattice Dynamical Properties of Textured Diamond Films. Physica Status Solidi B. 1999, s. 189–192. doi:10.1002/(SICI)1521-3951(199909)215:1<189::AID-PSSB189>3.0.CO;2-X. Bibcode 1999PSSBR.215..189A.
- ↑ Mansoori, G. Ali. Principles of nanotechnology: molecular-based study of condensed matter in small systems. [s.l.]: World Scientific, 2005. Dostupné online. ISBN 981-256-154-4. S. 12.
- ↑ John Dalton Wright. Molecular crystals. [s.l.]: Cambridge University Press, 1995. ISBN 0-521-47730-1. S. 28.
- ↑ NMR, infračervená, a hmotnostní spektra adamantanu jsou umístěna v databázi SDBS Archivováno 6. 3. 2023 na Wayback Machine.
- ↑ March, J. Organic chemistry. Reactions, mechanisms, structure. Advanced course for universities and higher education chemical. [s.l.]: [s.n.], 1987. S. 137.
- ↑ Applequist, J.; RIVERS, P.; APPLEQUIST, D. E. Theoretical and experimental studies of optically active bridgehead-substituted adamantanes and related compounds. Journal of the American Chemical Society. 1969, s. 5705–5711. doi:10.1021/ja01049a002.
- ↑ Hamill, H.; MCKERVEY, M. A. The resolution of 3-methyl-5-bromoadamantanecarboxylic acid. Chemical Communications. 1969, s. 864. doi:10.1039/C2969000864a.
- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry, 2014. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001. S. 169.
- ↑ Schleyer P. R.; FORT R. C.; WATTS W. E. Stable Carbonium Ions. VIII. The 1-Adamantyl Cation. Journal of the American Chemical Society. 1964, s. 4195–4197. doi:10.1021/ja01073a058.
- ↑ OLAH, George A.; PRAKASH, G. K. Surya; SHIH, Joseph G.; KRISHNAMURTHY, V. V.; MATEESCU, Gheorge D.; LIANG, Gao; SIPOS, Gyorgy. Bridgehead adamantyl, diamantyl, and related cations and dications. Journal of the American Chemical Society. 1985, s. 2764–2772. doi:10.1021/ja00295a032.
- ↑ Smith, W.; BOCHKOV A.; CAPLE, R. Organic Synthesis. Science and art. [s.l.]: [s.n.], 2001. ISBN 5-03-003380-7. S. 573.
- ↑ BREMER, Matthias; VON RAGUÉ SCHLEYER, Paul; SCHÖTZ, Karl; KAUSCH, Michael; SCHINDLER, Michael. Four-Center Two-Electron Bonding in a Tetrahedral Topology. Experimental Realization of Three-Dimensional Homoaromaticity in the 1,3-Dehydro-5,7-adamantanediyl dication. Angewandte Chemie International Edition in English. 1987, s. 761–763. doi:10.1002/anie.198707611.
- ↑ GELUK, H. W.; KEIZER, V. G. Adamantanone. Organic Syntheses. 1973, s. 8. doi:10.15227/orgsyn.053.0008.
- ↑ 2-Adamantanecarbonitrile Archivováno 10. 7. 2012 na Wayback Machine. Organic Syntheses, Coll. Vol. 6, p. 41 (1988); Vol. 57, p. 8 (1977)
- ↑ Schleyer P. R.; NICHOLAS R. D. The Preparation and Reactivity of 2-Substituted Derivatives of Adamantane. Journal of the American Chemical Society. 1961, s. 182–187. doi:10.1021/ja01462a036.
- ↑ Synthesis of adamantane [online]. [cit. 2009-12-11]. Dostupné online. (rusky) Special practical problem for the students of IV year. Department of Petroleum Chemistry and Organic Catalysis MSU.
- ↑ A. N. Nesmeyanov. Basic organic chemistry. [s.l.]: [s.n.], 1969. S. 664.
- ↑ George A. Olah; WELCH, John T.; VANKAR, Yashwant D.; NOJIMA, Mosatomo; KEREKES, Istvan; OLAH, Judith A. Pyridinium poly(hydrogen fluoride): a convenient reagent for organic fluorination reactions. Journal of Organic Chemistry. 1979, s. 3872–3881. doi:10.1021/jo01336a027.
- ↑ , George A. Olah; SHIH, Joseph G.; SINGH, Brij P.; GUPTA, B. G. B. Ionic fluorination of adamantane, diamantane, and triphenylmethane with nitrosyl tetrafluoroborate/pyridine polyhydrogen fluoride (PPHF). Journal of Organic Chemistry. 1983, s. 3356–3358. doi:10.1021/jo00167a050.
- ↑ Shlomo Rozen; GAL, Chava. Direct synthesis of fluoro-bicyclic compounds with fluorine. Journal of Organic Chemistry. 1988, s. 2803–2807. doi:10.1021/jo00247a026.
- ↑ Koch, H.; HAAF, W. 1-Adamantanecarboxylic acid. Organic Syntheses. 1964. doi:10.15227/orgsyn.044.0001.
- ↑ Zvi Cohen; HAIM VARKONY; EHUD KEINAN; YEHUDA MAZUR. Tertiary alcohols from hydrocarbons by ozonation on silica gel: 1-adamantanol. Organic Syntheses. 1979, s. 176. doi:10.15227/orgsyn.059.0176.
- ↑ George W. Smith; HARRY D. WILLIAMS. Some Reactions of Adamantane and Adamantane Derivatives. The Journal of Organic Chemistry. 1961, s. 2207–2212. doi:10.1021/jo01351a011.
- ↑ I. K. Moiseev; R. I. DOROSHENKO; V. I. IVANOVA. Synthesis of amantadine via the nitrate of 1-adamantanol. Pharmaceutical Chemistry Journal. 1976, s. 450–451. doi:10.1007/BF00757832.
- ↑ Keiji Watanabe et al. Resist Composition and Pattern Forming Process [online]. Bandwidth Market, 2001 [cit. 2005-10-14]. Dostupné v archivu pořízeném z originálu dne September 4, 2011.
- ↑ K. Lenzke; L. LANDT; M. HOENER. Experimental determination of the ionization potentials of the first five members of the nanodiamond series. The Journal of Chemical Physics. 2007, s. 084320. doi:10.1063/1.2773725. PMID 17764261. Bibcode 2007JChPh.127h4320L.
- ↑ MAUGH, T. Panel urges wide use of antiviral drug. Science. 1979, s. 1058–1060. doi:10.1126/science.386515. PMID 386515. Bibcode 1979Sci...206.1058M.
- ↑ Lynn Sonnberg. The Complete Pill Guide: Everything You Need to Know about Generic and Brand-Name Prescription Drugs. [s.l.]: Barnes & Noble Publishing, 2003. ISBN 0-7607-4208-1. S. 87.
- ↑ T. A. Blanpied, R. J. Clarke, J. W. Johnson. Amantadine inhibits NMDA receptors by accelerating channel closure during channel block. Journal of Neuroscience. 2005, s. 3312–3322. doi:10.1523/JNEUROSCI.4262-04.2005. PMID 15800186.
- ↑ A. G. Boukrinskaia et al. Polymeric Adamantane Analogues [online].
- ↑ AIS-EHT1 Micro End Hall Thruster – Applied Ion Systems [online]. [cit. 2021-02-22]. Dostupné online.
- ↑ Hamid Ramezani; G. ALI MANSOORI. Diamondoids as Molecular Building Blocks for Nanotechnology. [s.l.]: [s.n.], 2007. Dostupné online. ISBN 978-0-387-39937-9. doi:10.1007/978-0-387-39938-6_4. S. 44–71.
- ↑ J. J. Vitall. The Chemistry of Inorganic and Organometallic Compounds with Adamantane-Like Structures. Polyhedron. 1996, s. 1585–1642. doi:10.1016/0277-5387(95)00340-1.
- ↑ Jelena Fischer; JUDITH BAUMGARTNER; CHRISTOPH MARSCHNER. Synthesis and Structure of sila-adamantane. Science. 2005, s. 825. doi:10.1126/science.1118981. PMID 16272116.
- ↑ MANCINI, Ines; GUELLA, Graziano; FROSTIN, Maryvonne; HNAWIA, Edouard; LAURENT, Dominique; DEBITUS, Cecile; PIETRA, Francesco. On the First Polyarsenic Organic Compound from Nature: Arsenicin a from the New Caledonian Marine Sponge Echinochalina bargibanti. Chemistry: A European Journal. 2006, s. 8989–8994. doi:10.1002/chem.200600783. PMID 17039560.
- ↑ TÄHTINEN, Petri; SAIELLI, Giacomo; GUELLA, Graziano; MANCINI, Ines; BAGNO, Alessandro. Computational NMR Spectroscopy of Organoarsenicals and the Natural Polyarsenic Compound Arsenicin A. Chemistry: A European Journal. 2008, s. 10445–10452. doi:10.1002/chem.200801272. PMID 18846604.
- ↑ GUELLA, Graziano; MANCINI, Ines; MARIOTTO, Gino; ROSSI, Barbara; VILIANI, Gabriele. Vibrational analysis as a powerful tool in structure elucidation of polyarsenicals: a DFT-based investigation of arsenicin A. Physical Chemistry Chemical Physics. 2009, s. 2420–2427. doi:10.1039/b816729j. PMID 19325974. Bibcode 2009PCCP...11.2420G.
- ↑ Di Lu; A. DAVID RAE; GEOFF SALEM; MICHELLE L. WEIR; ANTHONY C. WILLIS; S. BRUCE WILD. Arsenicin A, A Natural Polyarsenical: Synthesis and Crystal Structure. Organometallics. 2010, s. 32–33. doi:10.1021/om900998q.
Externí odkazy
 Obrázky, zvuky či videa k tématu adamantan na Wikimedia Commons
Obrázky, zvuky či videa k tématu adamantan na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Skeletal formula of adapalene—a topical retinoid used in the treatment of acne vulgaris. Created with ChemDoodle 7.0.2 and Adobe Illustrator CC.
Autor: Organic squirrel, Licence: CC BY-SA 4.0
Bond lengths and angles of adamantane - a hydrocarbon whose carbon skeleton resembles the smallest unit of diamond lattice.
Chemical structure of arsenicin A
1-adamantanecarboxylic acid synthesis
Synthesis of dicarbocation of adamantane, including one of its resonance structures and the delocalized resonance-hybrid
Synthesis of adamantane by hydrogenation of dicyclopentadiene to give tricyclodecane followed by Lewis acid catalyzed rearrangement
Synthesis of amantadine from adamantane Adapted from I. K. Moiseev, R. I. Doroshenko and V. I. Ivanova (1976). "Synthesis of amantadine via the nitrate of 1-adamantanol". Pharmaceutical Chemistry Journal 10 (4): 450-451. DOI:10.1007/BF00757832.
Bromination of adamantane in different conditions
created with bkchem+inkscape
Chemical compound - Meerwein's Ester. Precursor in adamantane and barbaralan synthesis.
Hexamethylenetetramine; Hexamine
Chemical structure of memantine.
Synthesis of adamantanone
Autor: raster original by Benjah-bmm27
Vektorizace: B. Jankuloski, Licence: CC0
Phosphorus pentoxide chemical structure in 2D.
Synthesis of 1-adamantanol from adamantane.
Chemical structure of tromantadine. Created with ChemDoodle 7.0.2 and Adobe Illustrator CC.
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the adamantane molecule, a hydrocarbon with a diamondoid structure.
Used colors:
- Uhlík, C: černá
- Vodík, H: bílá
(c) Materialscientist na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
adamanatane powder
Structural diagram of vildagliptin—an anti-diabetic medication belonging to class of dipeptidyl peptidase-4 inhibitors. Sold under trade names Galvus and Zomelis. Created using ACD/ChemSketch 8.0 and Inkscape.
Chemical Structure of Adamantane
Autor: Nuklear, Licence: CC BY-SA 4.0
Skeletal formula of bromantane (trade name Ladasten) — an anxiolytic and stimulant medication used in the treatment of neurasthenia and asthenia.
Synthesis of adamantane by V.Prelog
Chemical structure of adamantane.