Adiponitril
| Adiponitril | |
|---|---|
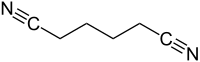 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | hexandinitril |
| Funkční vzorec | N≡C(CH2)4C≡N |
| Sumární vzorec | C6H8N2 |
| Vzhled | bezbarvá až nažloutlá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 111-69-3 |
| EC-no (EINECS/ELINCS/NLP) | 203-896-3 |
| PubChem | 8128 |
| SMILES | C(CCC#N)CC#N |
| InChI | 1S/C6H8N2/c7-5-3-1-2-4-6-8/h1-4H2 |
| Číslo RTECS | AV2625000 |
| Vlastnosti | |
| Molární hmotnost | 108,14 g/mol |
| Teplota tání | 1 °C (274 K)[1] |
| Teplota varu | 295 °C (568 K)[1] |
| Hustota | 0,965 g/cm3 (20 °C)[1] |
| Rozpustnost ve vodě | 8 g/100 ml (20 °C)[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v methanolu, ethanolu a chloroformu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v aromatických uhlovodících, omezeně rozpustný v diethyletheru, sirouhlíku a alifatických uhlovodících[1] |
| Tlak páry | 0,3 Pa (20 °C) 0,3 kPa (119 °C)[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H301 H315 H319 H332 H335[1] |
| P-věty | P260 P261 P264+265 P270 P271 P280 P284 P301+316 P302+352 P304+340 P305+351+338 P316 P317 P319 P320 P321 P330 P332+317 P337+317 P362+364 P403+233 P405 P501[1] |
| Teplota vzplanutí | 93 °C (366 K)[1] |
| Teplota vznícení | 550 °C (823 K)[1] |
Některá data mohou pocházet z datové položky. | |
Adiponitril je organická sloučenina se vzorcem (CH2)4(CN)2, používaná na výrobu nylonu 66.
Výroba
První postupy
Vzhledem k průmyslovému významu adiponitrilu bylo vyvinuto několik způsobů jeho výroby. První průmyslové postupy byly založeny na použití furfuralu a na chloraci buta-1,3-dienu na 1,4-dichlor-but-2-en, který se po reakci s kyanidem sodným měnil na hex-3-endinitril, posléze hydrogenovaný na adiponitril:[2]
- ClCH2CH=CHCH2Cl + 2 NaCN → NCCH2CH=CHCH2CN + 2 NaCl
- NCCH2CH=CHCH2CN + H2 → NC(CH2)4CN
Adiponitril se ojediněle také vyráběl z kyseliny adipové dehydratací jejího diamidu.
Moderní postupy
Od roku 2004 se většina adiponitrilu vyrábí hydrokyanací butadienu katalyzovanou niklem. Celková rovnice vypadá takto:
- CH2=CHCH=CH2 + 2 HCN → NC(CH2)4CN
Proces se skládá z několika částí, první je monohydrokyanace (navázání jedné molekuly HCN), čímž vnikají (navzájem izomerní) pentennitrily a také 2- a 3-methylbutannitrily. Tyto sloučeniny se poté izomerizují na penten-3- a penten-4-nitrily. V posledním kroku se pentennitrily znovu, proti Markovnikovovu pravidlu, hydrokyanují a vzniká adiponitril.[2]
Penten-3-nitril, vzniklý při první hydrokyanaci, může projít metatezí alkenu za tvorby dikyanobutenů, které se snadno hydrogenují. Užitečným vedlejším produktem výroby adiponitrilu je 2-methylglutaronitril.
Dalšími významnými metodami jsou hydrodimerizace, která začíná u akrylonitrilu:[3]
- 2 CH2=CHCN + 2 e− + 2 H+ → NCCH2CH2CH2CH2CN
Použití
Téměř všechen vyrobený adiponitril se hydrogenuje na hexan-1,6-diamin, sloužící na výrobu nylonu 66:[5]
- NC(CH2)4CN + 4 H2 → H2N(CH2)6NH2
Podobně jako další nitrily lze adiponitril hydrolyzovat; vzniklou kyselinu adipovou lze ale levněji vyrobit jinými postupy.
V roce 2018 se mohlo vyrobit až kolem 1,5 milionů tun adiponitrilu
Bezpečnost
LD50 adiponitrilu u krys při ústním podání je 300 mg/kg.[2]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Adiponitrile na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m https://pubchem.ncbi.nlm.nih.gov/compound/8128
- ↑ a b c M. T. Musser, "Adipic Acid" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI:10.1002/14356007.a01_269
- ↑ D. S. Cardoso; B. Šljukić; D. M. Santos; C. A. Sequeira. Organic Electrosynthesis: From Laboratorial Practice to Industrial Applications. Organic Process Research & Development. 2017-07-17, s. 1213–1226. DOI 10.1021/acs.oprd.7b00004.
- ↑ Manuel M. Baizer. Electrolytic Reductive Coupling. Journal of the Electrochemical Society. 1964, s. 215. DOI 10.1149/1.2426086.
- ↑ Robert A. Smiley Hexamethylenediamine, Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005 DOI:10.1002/14356007.a12_629
Externí odkazy
 Obrázky, zvuky či videa k tématu Adiponitril na Wikimedia Commons
Obrázky, zvuky či videa k tématu Adiponitril na Wikimedia Commons - www.chemicalland.com
- www.nist.gov
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Butadiene hydrocyanation
Strukturformel
Adiponitrile Synthesis
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the Adiponitrile molecule, a nitrile related to adipic acid.
Color code:
- Uhlík, C: černá
- Vodík, H: bílá
- Nitrogen, N: blue









