Aldolová kondenzace
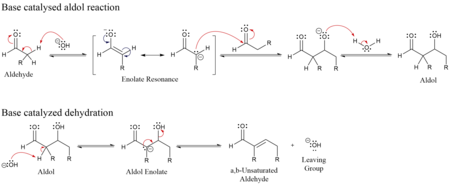
Aldolová kondenzace je kondenzační reakce v organické chemii, při níž reagují dvě molekuly karbonylové sloučeniny za vzniku β-hydroxyaldehydu nebo β-hydroxyketonu (což je aldolová reakce) a následně dojde k dehydrataci, čímž vzniká konjugovaný enon.
Aldolové kondenzace jsou v organické chemii důležité, neboť představují dobrý způsob, jak vytvořit C-C vazby,[1] je například součástí Robinsonovy anelace[1], vzniklý Wielandův–Miescherův keton je důležitou výchozí látkou v mnoha organických syntézách.[2] Aldolová kondenzace byla také zmíněna jako vhodná vazbotvorná reakce, která ukazuje důležité reakční mechanismy.[3][4][5] Dochází při ní k nukleofilní adici ketoenolátu na aldehyd za vzniku β-hydroxy ketonu neboli aldolu (aldehyd + alkohol), strukturní jednotky přítomné v mnoha léčivech a přírodních látkách.[6][7][8]
Název aldolová kondenzace se také často, obzvláště v biochemii, používá pro první (adiční) část procesu – samotnou aldolovou reakci – katalyzovanou aldolázami, i když ve skutečnosti nejde o kondenzační reakci, protože nedochází k odštěpení malé molekuly.
Reakce mezi aldehydem či ketonem a aromatickou karbonylovou sloučeninou bez alfa-vodíku se nazývá Claisenova–Schmidtova kondenzace, objevili ji Rainer Ludwig Claisen a J. G. Schmidt.[9][10][11], příkladem je syntéza dibenzylidenacetonu.[12]
Mechanismus
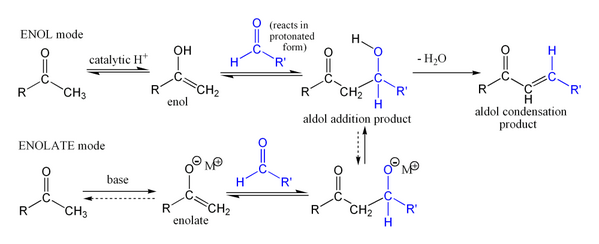
První částí aldolové kondenzace je aldolová reakce, druhou je eliminační reakce – dochází k odštěpení molekuly vody nebo alkoholu (tato část může být spojena s dekarboxylací, kde je přítomna aktivovaná karboxylová skupina), která může proběhnout dvěma mechanismy: za použití silné zásady jako je například terc-butoxid draselný, hydroxid draselný či hydrid sodný enolátovým mechanismem[13] a nebo kysele katalyzovaným enolovým mechanismem.
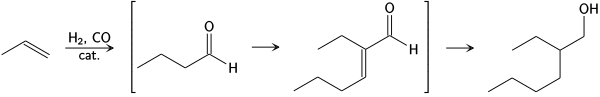
Aldox proces
Společnostmi Shell a Exxon byl vyvinut aldox proces, kterým se převádí propen na 2-ethylhexanol přes hydroformylaci butyraldehydu, aldolovou kondenzaci 2-ethylhexenalu a následnou hydrogenaci:
V jedné studii byl krotonaldehyd přeměněn na 2-ethylhexanal[14]:
Reference
V tomto článku byl použit překlad textu z článku Aldol condensation na anglické Wikipedii.
- ↑ a b Carey, Francis A.; SUNDBERG, RICHARD J. Advanced Organic Chemistry Part B Reactions and Synthesis. 3rd. vyd. 233 Spring Street, NY: Plenum, 1993. Dostupné online. ISBN 0-306-43440-7. S. 55.
- ↑ Dzierba, C. D.; Zandi, K. S.; Moellers, T.; Shea, K. J. An Ascending Synthesis of Adrenalcorticosteroids. The Total Synthesis of (+)-Adrenosterone. J. Am. Chem. Soc. 1996, 118, 4711–4712.
- ↑ Wade, L. G. Organic Chemistry. 6th. vyd. Upper Saddle River, NJ: Prentice Hall, 2005. ISBN 0-13-236731-9. S. 1056–1066.
- ↑ Smith, M. B.; MARCH, J. Advanced Organic Chemistry. 5th. vyd. New York: Wiley Interscience, 2001. ISBN 0-471-58589-0. S. 1218–1223.
- ↑ Mahrwald, R. Modern Aldol Reactions. Weinheim, Germany: Wiley-VCH, 2004. Dostupné online. ISBN 3-527-30714-1. S. 1218–1223.
- ↑ Heathcock, C. H. Additions to C-X π-Bonds, Part 2. Oxford: Pergamon, 1991. (Comprehensive Organic Synthesis. Selectivity, Strategy and Efficiency in Modern Organic Chemistry; sv. 2). ISBN 0-08-040593-2. S. 133–179.
- ↑ Mukaiyama T. The Directed Aldol Reaction. Organic Reactions. 1982, s. 203–331. DOI 10.1002/0471264180.or028.03.
- ↑ Paterson, I. New Asymmetric Aldol Methodology Using Boron Enolates. Chemistry and Industry. London: Paterson Group, 1988, s. 390–394.
- ↑ Claisen, L.; CLAPARÈDE, A. Condensationen von Ketonen mit Aldehyden. Berichte der Deutschen Chemischen Gesellschaft. 1881, s. 2460–2468. Dostupné online. DOI 10.1002/cber.188101402192.
- ↑ Schmidt, J. G. Ueber die Einwirkung von Aceton auf Furfurol und auf Bittermandelöl in Gegenwart von Alkalilauge. Berichte der Deutschen Chemischen Gesellschaft. 1881, s. 1459–1461. Dostupné online. DOI 10.1002/cber.188101401306.
- ↑ March, J. Advanced Organic Chemistry: Reactions, Mechanisms and Structure. 3rd. vyd. [s.l.]: Wiley Interscience, 1985. ISBN 0-471-85472-7.
- ↑ RAHMAN, A. F. M. Motiur; ALI, Roushown; JAHNG, Yurngdong. A Facile Solvent Free Claisen-Schmidt Reaction: Synthesis of α,α′-bis-(Substituted-benzylidene)cycloalkanones and α,α′-bis-(Substituted-alkylidene)cycloalkanones. Molecules. 2012-01-09, roč. 17, čís. 1, s. 571–583. Dostupné online [cit. 2024-03-17]. ISSN 1420-3049. DOI 10.3390/molecules17010571. PMID 22231494. (anglicky)
- ↑ Nielsen, A. T.; HOULIHAN., W. J. The Aldol Condensation. Organic Reactions. 1968, s. 1–438. DOI 10.1002/0471264180.or016.01.
- ↑ Seki, T.; GRUNWALDT, J.-D.; BAIKER, A. Continuous catalytic "one-pot" multi-step synthesis of 2-ethylhexanal from crotonaldehyde. Chemical Communications. 2007, s. 3562–3564. DOI 10.1039/b710129e.
Externí odkazy
 Obrázky, zvuky či videa k tématu Aldolová kondenzace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Aldolová kondenzace na Wikimedia Commons
Média použitá na této stránce
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Crotonaldehyde Aldol
Base-catalysed mechanism for the aldol reaction (including the aldol condensation), via an enolate. Created in ChemDraw by User:Walkerma, January 2006.
Aldox chemical reaction process
Acid-catalysed mechanism for the aldol reaction (including the aldol condensation), via an enol. Created in ChemDraw by User:Walkerma, January 2006.
(c) I, Pansanel, CC BY-SA 3.0
Schéma d'une réaction de condensation aldolique suivie d'une crotonisation