Alkoholy
Alkoholy jsou nearomatické hydroxylové deriváty uhlovodíků. Tyto organické sloučeniny obsahují skupinu OH a mají velký význam. Nejznámější ze skupiny alkoholů je ethanol, který je znám svým hojným využitím v průmyslu paliv (biopaliva), potravinářství (alkoholické nápoje – konkrétně ethanol, užíván jako rekreační droga), kosmetice a především v mnoha reakcích v organické syntéze.
Chemické zařazení
Alkoholy jsou organické chemické sloučeniny ze skupiny hydroxyderivátů. Deriváty uhlovodíků, které vznikají náhradou jednoho či více atomů vodíku na atomu uhlíku nearomatického uhlovodíku hydroxylovou skupinou (-OH).
Dělení alkoholů
Alkoholy lze dělit z několika hledisek do více skupin. Základní dělení vychází z počtu hydroxylových skupin vázaných k uhlovodíkovému zbytku:
- alkoholy (jednosytné) – obsahují jednu -OH skupinu
- dioly (dvojsytné alkoholy) – obsahují dvě vázané -OH skupiny
- trioly (trojsytné alkoholy) – obsahují tři vázané -OH skupiny
- tetraoly (čtyřsytné alkoholy) – obsahují čtyři vázané -OH skupiny
- pentaoly, hexaoly, heptaoly, atd.
- polyoly – vícesytné alkoholy
Alkoholy se také dělí podle druhu radikálu, který vznikne odtržením radikálu .OH z molekuly alkoholu:
- primární alkoholy – vzniká primární radikál (na uhlík s navázaným hydroxylem jsou přímo vázány 2 vodíky, u methanolu 3)
- sekundární alkoholy – vzniká sekundární radikál (na uhlík s navázaným hydroxylem je přímo vázán 1 vodík)
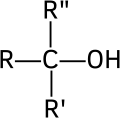
- terciární alkoholy – vzniká terciární radikál (na uhlík s navázaným hydroxylem není přímo vázán žádný vodík)
- Primární alkohol
- Sekundární alkohol
- Terciární alkohol
Alkoholy lze rovněž rozdělit dle typu uhlovodíkového zbytku, na který je hydroxylová skupina vázána:
- acyklické alkoholy – hydroxylová skupina je vázána k atomu uhlíku necyklického uhlovodíkového zbytku
- alicyklické (cyklické) alkoholy – hydroxylová skupina je vázána k atomu uhlíku cyklického uhlovodíkového zbytku
Poznámka:
- Fenoly tvoří samostatnou skupinu hydroxyderivátů, kde je hydroxyl -OH vázaný na atomu uhlíku v hybridním stavu sp2ar.
- Kombinací všech možností lze specifikovat přibližnou strukturu alkoholu (a tedy i jeho vlastnosti), např. alicyklický triol, alifatický diol, atp.
Názvosloví
Použití
Alkoholy jsou hojně rozšířeny v přírodě, zejména ve formě esterů (tuky, vosky, pryskyřice, atd.). Alkoholy se získávají kvasnými pochody (ethanol, butanol), hydrogenací fenolů (cyklohexanol), esterů a dalších derivátů karboxylových kyselin, redukcí karbonylových sloučenin, hydrolýzou halogenderivátů atd. Nižší alkoholy jsou neomezeně mísitelné s vodou. Alkoholy se používají jako rozpouštědla, jako výchozí suroviny pro chemický průmysl, zejména pro přípravu esterů a dalších produktů z oblasti umělých hmot, výbušnin; pro výrobu léčiv, pro potravinářství atd. Důležitými alkoholy jsou například methanol (methylalkohol), ethanol (ethylalkohol), cyklohexanol, benzylalkohol, ethylenglykol (1,2-ethandiol), glycerol (1,2,3-propantriol). Některé alkoholy (např. ethanol, methanol) jsou nervové jedy.
Nebezpečí
Spousta alkoholů patří mezi jedovaté látky. Příkladem může posloužit ethanol: pokud se dostane do těla, otupuje smysly a vnímání okolí. Zvláště nebezpečné je řízení auta pod jeho vlivem. Drogová závislost na alkoholu se nazývá alkoholismus. Co se jedovatosti a nebezpečnosti týče, je prudce jedovatý methanol, který se snadno zaměňuje za líh (ethanol), poté zdraví škodlivý ethylenglykol a glycerol, jenž nepatří mezi látky toxické a který se používá k vylepšování vlastností likérů pro jeho nasládlou chuť. Smrtelná dávka methanolu je někdy již pouhých 10 ml.
Projevy otravy
Projevy otravy začínají obvykle alkoholovým opojením, bolestí břicha, otupením smyslů, malátností následující zvracením, ztrátou vědomí, bezvědomím, u některých alkoholů trvalou slepotou (zejména methanol) a nakonec úmrtím. Dále se to může projevit třeba ztrátou rovnováhy a výtržným chováním, na které je třeba dávat si pozor. Při konzumaci většího množství alkoholu je vhodné prokládat pití vodou.
Interakce s léčivy
- Antibiotika – Při požití společně s alkoholem způsobují cirhózu jater. Nebezpečí tkví hlavně v třídenních antibiotikách, které se po ukončení léčby udržují v těle nejméně 3 dny. Časový limit pro pití alkoholu je tedy závislý na druhu antibiotik a může se lišit v rozmezí 12 hodin až 3 dnů.
- antidepresiva – Požívání alkoholu společně s antidepresivy zvyšuje nebo naopak snižuje deprese, ale vždy po vystřízlivění následují těžké depresivní stavy, které mizí asi po 24 hodinách. Zvyšuje se riziko vzniku závislosti na alkoholu. Jedinec má taky mírně snížený práh pro otravu.
- Methylfenidát – též známý jako Ritalin, je zesíleno působení účinku alkoholu i léku. Jedinec se již po dvou pivech cítí velmi opilý, točí se mu hlava. Je zvýšená koncentrace, ale také vyšší riziko vzniku závislosti a to zejména na alkohol. Jedinec vypadá vůči svému okolí jako, že je mimo, ale sám se cítí být více koncentrovaný a více vnímá ze svého okolí. Lék společně s alkoholem snižuje i práh pro otravu.
- Paracetamol – Paracetamol obsažený například v paralenu či panadolu poškozuje při předávkování játra, stejně jako alkohol, proto se od požití 500 mg nejméně 4 h velmi výrazně nedoporučuje pít alkohol. Při užívání s alkoholem velmi zvyšuje riziko cirhózy jater.
Externí odkazy
 Obrázky, zvuky či videa k tématu alkoholy na Wikimedia Commons
Obrázky, zvuky či videa k tématu alkoholy na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Hydroxy group na anglické Wikipedii. V tomto článku byl použit překlad textu z článku Alkohole na německé Wikipedii.
Média použitá na této stránce
Structure of methanol
chemical structure of propan-1-ol, made using BKchem
Chemical stucture of isobutanol, made using BKchem
Condensed formula of a tertiary alcohol.
1-Butanol
Condensed formula of a primary alcohol.
Structural formula of ethylene glycol
Ethanol chemical structure
2-Propanol; Isopropanol
Condensed formula of a secondary alcholol