Allylchlorid
| Allylchlorid | |
|---|---|
 Strukturní vzorec | |
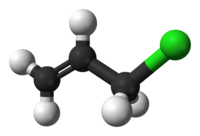 Tyčinkový model molekuly | |
 Kalotový model molekuly | |
| Obecné | |
| Systematický název | 3-chlorprop-1-en |
| Ostatní názvy | 3-chloropren |
| Anglický název | Allyl chloride |
| Sumární vzorec | C3H5Cl |
| Vzhled | bezbarvá, hnědá, žlutá či růžová kapalina |
| Identifikace | |
| Registrační číslo CAS | 107-05-1 |
| PubChem | 7850 |
| SMILES | C=CCCl |
| InChI | 1S/C3H5Cl/c1-2-3-4/h2H,1,3H2 |
| Vlastnosti | |
| Molární hmotnost | 76,52 g/mol |
| Teplota tání | −135 °C (138 K) |
| Teplota varu | 45 °C (318 K) |
| Hustota | 0,94 g/cm3 |
| Index lomu | 1,4055 |
| Rozpustnost ve vodě | 0,36 g/100 ml (20 °C) |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu a chloroformu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru a benzenu |
| Tlak páry | 39,3 kPa |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R11 R20/21/22 R36/37/38 R40 R48/20 R50 R68 |
| S-věty | S2 S16 S25 S26 S36/37 S46 S61 |
| Teplota vzplanutí | −32 °C (241 K) |
| Teplota vznícení | 390 °C (663 K) |
Některá data mohou pocházet z datové položky. | |
Allylchlorid je organická sloučenina, chlorovaný derivát propenu (patří tedy mezi halogenderiváty). Je prakticky nerozpustný ve vodě ale dobře rozpustný v běžných organických rozpouštědlech. Většinou se převádí na epichlorhydrin, který se používá ve výrobě plastů. Je to alkylační činidlo, což jej činí nebezpečným při skladování.
Výroba a příprava
V laboratoři
Allylchlorid poprvé připravili roku 1857 Auguste Cahours a August Hofmann reakcí allylalkoholu s chloridem fosforitým.[2][3] Moderní návody upřednostňují tento postup před poměrně drahým použitím chloridu fosforitého s kyselinou chlorovodíkovou a katalyzátorem, jako je například chlorid měďný.
V průmyslu
Allylchlorid se vyrábí chlorací propenu. Při nižších teplotách vzniká 1,2-dichlorpropan, ovšem je-li teplota vyšší než 500 °C, převažuje allylchlorid, který se tvoří radikálovou reakcí:
- CH3CH=CH2 + Cl2 → ClCH2CH=CH2 + HCl
Tímto způsobem bylo v roce 1997 vyrobeno asi 800 000 tun allylchloridu.[3]
Použití
Výrazná většina allylchloridu se převádí na epichlorhydrin.[3]
Jakožto alkylační činidlo se allylchlorid používá na výrobu léčiv a pesticidů jako je allylisothiokyanát.
Reakce
Jako ukázka reaktivity allylchloridu může posloužit jeho reakce s hořčíkem:
- 2 ClCH2CH=CH2 + Mg → (CH2)2(CH=CH2)2 + MgCl2
či kyanace na allylkyanid (CH2=CHCH2CN):
- 2 CH2=CHCH2Cl + KCN → CH2=CHCH2CN + KCl
Bezpečnost
Allylchlorid je toxický a hořlavý. Pokud se dostane do očí, může způsobit zhoršení zraku.
Odkazy
Související články
- Allyl
- Allylfluorid
- Allylbromid
- Allyljodid
Externí odkazy
 Obrázky, zvuky či videa k tématu p-Aminopropiofenon na Wikimedia Commons
Obrázky, zvuky či videa k tématu p-Aminopropiofenon na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Allyl chloride na anglické Wikipedii.
- ↑ a b Allyl chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Hofmann. Augustus William and Cahours. Augustus (1857) "Researches on a new class of alcohols," Philosophical Transactions of the Royal Society of London, 147: 555–574 ; see pp. 558–559.
- ↑ a b c Ludger Krähling, Jürgen Krey, Gerald Jakobson, Johann Grolig, Leopold Miksche “Allyl Compounds” in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2005. Published online: 15 June 2000.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
structure of allyl chloride
Ball-and-stick model of the allyl chloride molecule
Kalotový model molekuly včetně atomů vodíku










