Alosterická regulace

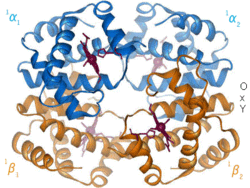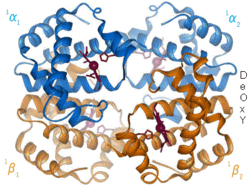
Alosterická regulace (z allos – jiný, stereos – prostor[1]) je ovlivnění vlastností určité oblasti (např. aktivního centra) enzymu, a to vazbou jistého efektoru (alosterického regulátoru) na jiné, tzv. alosterické místo.[1] Alosterické regulátory mohou být jak inhibitory (zejména nekompetitivní), tak aktivátory enzymů. Alosterická regulace mění prostorovou strukturu ovlivňovaných enzymů
Alosterické enzymy
Monod, Jacob a Wyman vypracovali představu o tom, jak by měly vypadat alostericky regulované enzymy. Uvádí, že to jsou obvykle oligomery tvořené z několika stejných nebo víceméně podobných podjednotek. Jsou schopné přecházet ze stavu aktivního do stavu neaktivního, přičemž oba stavy se liší svou prostorovou konformací. Přechod z jednoho stavu do druhého způsobuje vazba alosterického efektoru (či několika efektorů, z nichž například jeden působí inhibičně a druhý aktivačně). Je zajímavé, že průběh závislosti rychlosti alostericky regulované enzymatické reakce na koncentraci substrátu nemá hyperbolický průběh, nýbrž sigmoidní (esovitý) – přesný tvar křivky závisí mimo jiné na tom, zda se jedná o aktivátor či inhibitor. Pro správný popis alosterické regulace nestačí rovnice Michaelise a Mentenové, musí se používat specializované modely (např. MWC model nebo KNF model).[1]
Modelovým enzymem, který podléhá alosterické regulaci, je aspartáttranskarbamoyláza (ATCáza), enzym účastnící se biosyntézy pyrimidinů. Na její molekulu se může alostericky vázat inhibitor cytidintrifosfát (CTP), jeden z produktů pyrimidinové biosyntézy, takže se vlastně jedná o negativní zpětnou vazbu.[2]
Reference
Externí odkazy
 Obrázky, zvuky či videa k tématu Alosterická regulace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Alosterická regulace na Wikimedia Commons
Média použitá na této stránce
Autor: en:User:BerserkerBen, Licence: CC BY-SA 3.0
Animation of hemoglobin t-r state transformation