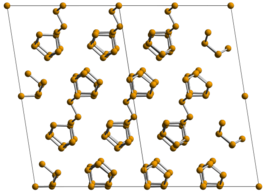Alotropie
Alotropie je schopnost některých chemických prvků vyskytovat se v několika různých strukturních formách (alotropických modifikacích). Jednotlivé alotropické modifikace se často liší typem krystalové soustavy nebo počtem atomů v molekule, fyzikálními a mechanickými vlastnostmi.
Příkladem výrazně alotropního prvku je uhlík, který se vyskytuje ve formě grafitu (tuha), diamantu, grafenu, fullerenů a ještě v několika dalších vzácných podobách. Jako jiný příklad lze uvést fosfor: bílý fosfor (označovaný též žlutý fosfor) je krystalický, červený fosfor amorfní, fialový fosfor má strukturu tvořenou řetězci, které jsou mezi sebou propojeny a tvoří roviny. Černý fosfor je velmi stálý (na rozdíl od bílého fosforu, který je velmi reaktivní již při pokojové teplotě) a svými fyzikálním vlastnostmi připomíná spíše kovy. V případě kyslíku je nejběžnější dvouatomová molekula kyslíku (O2), která tvoří přibližně 21 % zemské atmosféry, ozón (O3) je tříatomová, velmi reaktivní alotropie kyslíku.
Pojem alotropie se používá pouze pro chemické prvky. U chemických sloučenin a technických slitin je obdobná vlastnost označována obecnějším termínem polymorfie.
Historie
Termín alotropie poprvé použil a popsal švédský chemik Jöns Jakob Berzelius (1779–1848).[1][2] Termín je etymologicky odvozen z řeckého slova allotropia znamenající přibližně proměnlivost, schopnost změny.[3] Poté, co byly vědeckou komunitou přijaty poznatky italského vědce Amedea Avogadra (1776–1856), došli okolo roku 1860 vědci k poznání, že prvky mohou existovat jako molekuly o více atomech a dvě základní formy alotropie kyslíku byly rozpoznány jako O2 a ozón O3.[4] Na počátku 20. století vědci prozkoumali, že u jiných prvků jako je např. uhlík, jsou rozdíly mezi jednotlivými alotropními formami způsobeny odlišnou krystalickou strukturou.
Již v roce 1912 Wilhelm Ostwald (německý vědec, spoluzakladatel fyzikální chemie a nositel Nobelovy ceny), uvedl, že alotropie prvků je vlastně jen zvláštním případem tehdy již poměrně dobře prozkoumaného fenoménu polymorfie sloučenin (zejména různých minerálů) a neexistuje žádný racionální důvod používat pro prvky odlišný pojem. Navrhl, aby se tento méně běžný termín přestal používat a ve všech případech byl nahrazen obecnějším termínem polymorfie.[5] Přestože řada významných chemiků později toto doporučení opakovala, IUPAC (Mezinárodní unie pro čistou a užitou chemii) a většina učebnic chemie stále preferuje používat pro chemické prvky speciální, odlišný termín alotropie.[6]
Příklady alotropie
Schopnost prvků vytvářet různé alotropní formy je ovlivněna několika faktory. Prvky které mají proměnlivější koordinační číslo nebo oxidační číslo (nazývané též oxidační stav nebo stupeň) mají větší tendenci vytvářet více alotropních forem. Dalším faktorem je schopnost katenace, tedy zřetězení atomů do různých otevřených nebo uzavřených struktur (typickým příkladem je uhlík).
Nekovové prvky
- Uhlík vytváří velké množství alotropních forem, které se liší především krystalickou strukturou a mají zásadně odlišné vlastnosti (viz též obrázky níže): grafit (tuha) je velmi měkký minerál, diamant je naopak nejtvrdší přírodní nerost, Lonsdaleit, grafen, fullereny a ještě několik dalších.
- Fosfor: bílý (též žlutý), červený, fialový, černý fosfor, diphosphorus.
- Kyslík: dvě nejběžnější alotropní formy kyslíku se liší počtem atomů v molekule: O2 a ozón (O3).
- Síra: kosočtverečná krystalografická soustava síry je stálá forma, na kterou postupně přecházejí ostatní modifikace (např. jednoklonná nebo homocyklické formy).
Polokovy
- Selen: se v přírodě vyskytuje nejméně v šesti alotropických modifikacích, ve třech červených monoklinických (jednoklonných) formách, v krystalické šedé a jako černý sklovitý selen v hexagonální (šesterečné) soustavě.
- Bor: má dvě základní formy – amorfní a kovovou. Kovová modifikace patří mezi velmi tvrdé látky. Dosahuje hodnoty 9,3 v Mohsově stupnici tvrdosti. Podrobněji se rozlišují 4 základní formy alotropie: α-rhombohedral and ß-rhombohedral, γ-orthorhombic a ß-tetragonal. Bór má obdobně jako uhlík schopnost vytvářet rozsáhlé molekulové sítě. Borospherene (připravený v roce 2014) má krystalickou strukturu podobnou uhlíkovým fullerenům, borophene (2015) má jednovrstvou (planární) strukturu podobnou grafenu.
- Křemík: může mít krychlovou krystalickou strukturu nebo být amorfní. Pro výrobu polovodičových součástek má zásadní význam výroba monokrystalického křemíku. Silicene má jednovrstvou strukturu opět podobnou grafenu.
- Germanium: α-germanium je semimetalické, se strukturu velmi podobnou diamantům, β-germanium je metalické, se strukturou jako beta-cín. Germanene má planární strukturu opět podobnou grafenu.
- Arsen: žlutý arsen je molekulární nemetalický As4, se strukturou jako bílý fosfor, šedý arsen je polymer a polokov, černý arsen je molekulární a nemetalický, se strukturou jako červený fosfor.
- Antimon: kovový antimon se vyskytuje v několika alotropních modifikacích: modrobílý kovový antimon (se strukturou jako šedý arsen) a nestálé nekovové formy žlutého a černého antimonu.
- Tellur: amorfní tellur je šedý nebo hnědý prášek, krystalický tellur má šesterečnou (hexagonální) krystalickou strukturu.
Kovy
Mezi kovovými prvky, které se vyskytují v přírodě (tedy po uran) a v dostatečném množství, je téměř polovina (27 prvků) alotropní za běžného tlaku. Jedná se o Li: lithium, Be: beryllium, Na: sodík, Ca: vápník, Ti: titan, Mn: mangan, Fe: železo, Co: kobalt, Sr: stroncium, Y: yttrium, Zr: zirkonium, Sn: cín, La: lanthan, Ce: cer, Pr: praseodym, Nd: neodym, Sm: samarium, Gd: gadolinium, Tb: terbium, Dy: dysprosium, Yb: ytterbium, Hf: hafnium, Tl: thallium, Th: thorium, Pa: protaktinium a U: uran.
Mezi technologicky důležitými kovy dochází k alotropickým změnám většinou při vysokých teplotách. V případě železa tavenina začíná krystalizovat při teplotě 1538 °C jako železo δ (též označováno jako vysokoteplotní modifikace železa α), které má kubickou prostorově centrovanou strukturu (BCC). Při dalším ochlazováním od teploty 1394 °C níže, se struktura mění na kubickou plošně centrovanou (FCC) která má název železo γ a je paramagnetická. Při teplotě 912 °C se krystalová struktura opět vrací na kubickou prostorově centrovanou jako železo β, které je také paramagnetické. Ochlazení pod tzv. Curieovou teplotou nepřináší již žádnou změnu ve struktuře, zůstává kubická prostorově centrovaná struktura (BCC), která je ale již feromagnetická a označuje se jako železo α. Další modifikace železa (nazývaná železo ε) vzniká až za extrémně vysokých tlaků (nad 10 GPa). Alotropní modifikace železa jsou velmi důležité také při výrobě různých druhů ocelí (v principu slitina železa s uhlíkem, přidáním různého (většinou malého) množství různých dalších, tzv. legujících prvků lze vyrobit mnoho druhů ocelí s různorodými vlastnostmi).[7][8]
Obdobně dochází k alotropním změnám v případě titanu (při teplotě 882 °C), zirkonia při 863 °C, kobaltu při 422 °C, uranu při teplotách 668 °C a 776 °C. Poněkud výjimečný je v tomto směru cín. Kovový cín se vyskytuje ve třech alotropních modifikacích: tzv. bílý cín (β-cín) je stabilní při pokojové teplotě a má čtverečnou (tetragonální) krystalografickou soustavu. Šedý cín (α-cín, má krychlovou (kubickou) krystalografickou strukturu. Přechod mezi bílým a šedým cínem začíná již při teplotě 13,2 °C. Jsou-li cínové předměty (dříve běžně používané cínové nádoby, ale též sošky, cínové figurky vojáčků nebo části historických varhan) dlouhodobě vystaveny nízkým teplotám, dochází postupně k přechodu původně bílého cínu na šedou modifikaci (rychlost závisí na teplotě) a protože šedý cín je velmi křehký, cínové předměty se postupně rozpadnou na prach. Tento jev (nejedná se o korozi!) je označován jako tzv. cínový mor a byl znám již od středověku, kdy k němu docházelo zejména na hradech, které se přes zimu prakticky nedaly vytopit a docházelo ke zničení cínových nádob.[9] Třetí forma cínu (γ-cín, anglicky rhombic tin) krystalizující v kosočtverečné (ortorombické) soustavě a vzniká z bílého β-cínu až při 160 °C. Další forma cínu (σ-cín) se vyskytuje až za velmi vysokých tlaků.
Pokud jde o lanthanoidy a aktinoidy cer, samarium, dysprosium a ytterbium mají po třech alotropních formách. Praseodym, neodym, gadolinium a terbium mají po dvou alotropních formách. Promethium, americium, berkelium a kalifornium mají po třech alotropních formách. Za zvláštní zmínku stojí plutonium, které má šest alotropních forem v pevném skupenství za „normálního“ tlaku. Jejich hustota se liší v poměru 4:3, což extrémně komplikuje všechny výrobní procesy a skladování. Sedmá alotropní forma plutonia existuje za velmi vysokých tlaků. Transuranové kovy Np: neptunium, Am: americium a Cm: curium jsou také alotropní.[10]
Galerie
Uhlík
- Grafit (tuha) je nejběžnější forma uhlíku a má tvrdost 1 až 2 na Mohsově stupnici tvrdosti.
- Diamant je druhá základní forma uhlíku a nejtvrdší přírodní minerál (10 na Mohsově stupnici tvrdosti, absolutní tvrdost je asi 1600× větší než tvrdost 1 na této stupnici).
- (c) Mstroeck, CC BY-SA 3.0Lonsdaleit je vzácná přírodní alotropní modifikací uhlíku. Krystalová struktura je podobná diamantu, krystalografická soustava je však šesterečná.
- Grafen tvoří jedna či několik málo vrstev rovinné sítě vzájemně propojených atomů uhlíku ve tvaru šestiúhelníků. Má mimořádné fyzikální vlastnosti a očekává se mnohostranné využití.
- Fullereny: atomy jsou uspořádány do sférických molekul tvořených šestiúhelníky a pětiúhelníky. Fullereny jsou mimořádně odolné vůči vnějším fyzikálním vlivům.
Fosfor
- Bílý fosfor
- Červený fosfor
- Fialový fosfor
- Černý fosfor
Odkazy
Související články
- Polymorfie: obecnější pojem stejného významu, používaný pro sloučeniny a slitiny
- Izomorfie
- Krystalografie
- Krystalická struktura
- Krystalografická soustava
Reference
V tomto článku byl použit překlad textu z článku Allotropy na anglické Wikipedii.
- ↑ BERZELIUS, Jac. Arsberättelse om Framstegen i Fysik och Kemi afgifven den 31 Mars 1840. Första delen.. Stockholm, Sweden: P.A. Norstedt & Söner, 1841. Dostupné online. S. 14. (Swedish)
- ↑ BERZELIUS, Jacob; WÖHLER, F., trans. Jahres-Bericht über die Fortschritte der physischen Wissenschaften. Jahres Bericht Über die Fortschritte der Physischen Wissenschaften. Tübingen, (Germany): Laupp'schen Buchhandlung, 1841, s. 13. Dostupné online. (German)
- ↑ A New English Dictionary on Historical Principles. [s.l.]: Oxford University Press, 1888. Kapitola allotropy, s. 238..
- ↑ JENSEN, W. B. The Origin of the Term Allotrope. J. Chem. Educ.. 2006, s. 838–39. DOI 10.1021/ed083p838. Bibcode 2006JChEd..83..838J..
- ↑ OSTWALD, Wilhelm; TAYLOR, W.W., trans. Outlines of General Chemistry. 3rd. vyd. London, England: Macmillan and Co., Ltd., 1912. Dostupné online. S. 104. From p. 104: "Substances are known which exist not only in two, but even in three, four or five different solid forms; no limitation to the number is known to exist. Such substances are called polymorphous. The name allotropy is commonly employed in the same connexion, especially when the substance is an element. There is no real reason for making this distinction, and it is preferable to allow the second less common name to die out."
- ↑ Jensen 2006, citing Addison, W. E. The Allotropy of the Elements (Elsevier 1964) that many have repeated this advice.
- ↑ Metals Handbook, Vol. 8 Metallography, Structures and Phase Diagrams. 8. vyd. Metals Park, Ohio: ASM International, 1973. (anglicky)
- ↑ MATHON, O. et al. Dynamics of the Magnetic and Structural α-ε Phase Transition in Iron. Physical Review Letters. 2004, roč. 93, s. 255503. DOI 10.1103/PhysRevLett.93.255503. (anglicky)
- ↑ Studijní materiály předmětu PřF:C3800 Materiály pro konzervaci a restaurování [online]. Přírodovědecká fakulta Masarykovy univerzity, 2014 [cit. 2022-03-10]. Kapitola Cín a olovo. Dostupné online.
- ↑ BENEDICT, U.; HAIRE, R. G.; PETERSON, J. R.; ITIE, J. P. Delocalisation of 5f electrons in curium metal under high pressure. Journal of Physics F: Metal Physics. 1985, roč. 15, čís. 2, s. L29–L35. DOI 10.1088/0305-4608/15/2/002. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu alotropie na Wikimedia Commons
Obrázky, zvuky či videa k tématu alotropie na Wikimedia Commons  Encyklopedické heslo Allotropie v Ottově slovníku naučném ve Wikizdrojích
Encyklopedické heslo Allotropie v Ottově slovníku naučném ve Wikizdrojích
Média použitá na této stránce
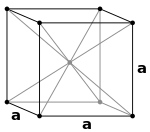
Diamond crystal structure consists of a face centered cubic lattice, each edge measures 3.6 Å.
Autor: Baszoetekouw at en.wikipedia, Licence: BSD
The face centered cubic crystal structure. Image created by Special:Emailuser/Bas Zoetekouw. Intended as replacement for Cubic-face-centered.png.
Autor: Martin Uhrin, Licence: CC BY-SA 4.0
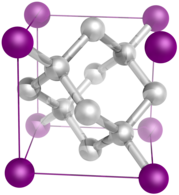
This unit cell contains 42 atoms and has spacegroup P-1
Ball-and-stick model of a sheet of phosphorus atoms in black phosphorus.
Crystal structure data from Wyckoff (1963) Crystal Structures - Second Edition, Volume 1. John Wiley, New York.
Image generated in Accelrys DS Visualizer.Autor: Bas Zoetekouw na projektu Wikipedie v jazyce angličtina, Licence: BSD
The body-centred cubic crystal structure.
Ball-and-stick model of the stacking of layers of chains in the crystal structure of violet phosphorus, also known as Hittorf's phosphorus.
X-ray crystallographic data from H. Thurn und H. Krebs (January 1969). "Über Struktur und Eigenschaften der Halbmetalle. XXII. Die Kristallstruktur des Hittorfschen Phosphors". Acta Cryst. B25 (1): 125-135. DOI:10.1107/S0567740869001853..
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.(c) Mstroeck, CC BY-SA 3.0
Mstroeck, držitel autorských práv k tomuto dílu, ho tímto zveřejňuje za podmínek následující licence: