Aminokyselina
- Biogenní aminokyseliny
- Glycin (Gly, G)
- Alanin (Ala, A)
- Valin (Val, V)
- Leucin (Leu, L)
- Isoleucin (Ile, I)
- Serin (Ser, S)
- Threonin (Thr, T)
- Tyrosin (Tyr, Y)
- Methionin (Met, M)
- Cystein (Cys, C)
- Lysin (Lys, K)
- Kyselina asparagová (Asp, D)
- Asparagin (Asn, N)
- Kyselina glutamová (Glu, E)
- Glutamin (Gln, Q)
- Arginin (Arg, R)
- Histidin (His, H)
- Fenylalanin (Phe, F)
- Tryptofan (Trp, W)
- Prolin (Pro, P)
- Selenocystein (SeCys,U)
- Pyrolysin (Pyl,O)
- N-formylmethionin (fMet)
Aminokyselina (často zkráceně jako AK nebo AmK) je v chemii obecně jakákoliv molekula obsahující karboxylovou (-COOH) a aminovou (-NH2) funkční skupinu. V biochemii se většinou tímto termínem rozumějí pouze alfa-aminokyseliny, tj. takové, ve kterých jsou obě skupiny navázány na stejném uhlíkovém atomu.
V ještě užším smyslu (například v molekulární biologii) se tímto pojmem většinou rozumí proteinogenní alfa-L-aminokyseliny – 20 (až 23) základních stavebních složek všech proteinů (bílkovin), které jsou připojovány při syntéze na ribozomu.
Struktura a důležité fyzikální vlastnosti
Aminokyseliny mají, jak již bylo zmíněno, dvě funkční skupiny – aminovou (-NH2) a karboxylovou (-COOH), což jim dodává zajímavé vlastnosti (viz níže).
Struktura
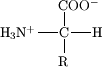
Ačkoliv existuje mnoho aminokyselin, v biochemii figurují pouze α-L-aminokyseliny (α-D-AMK se v přírodě prakticky nevyskytují s výjimkou buněčných stěn bakterií a některých antibiotik). Písmeno α zde značí, že aminoskupina je vázaná na α-uhlík (2. atom uhlíku řetězce karboxylové kyseliny); na něm je dále navázán jeden atom vodíku a postranní řetězec (na obrázku označen písmenem R). α-Uhlík je tím pádem také chirální uhlík. Neobvyklou strukturu má aminokyselina prolin, jehož -NH2 skupina je na α-uhlíku zacyklená s postranním řetězcem a obsahuje tedy sekundární amin. Glycin jako jediná biogenní aminokyselina není opticky aktivní, neboť kvůli přítomnosti dvou vodíků na α uhlíku má rovinu symetrie (nemůže se tedy rozlišit D- a L-glycin).
Příslušnost AMK k L- (vlevo) a D- (pravo) řadě se určuje podle prostorové orientace substituentů na α-uhlíku.
Fyzikální vlastnosti
Optická stáčivost
Díky přítomnosti chirálního uhlíku mají aminokyseliny schopnost stáčet rovinu polarizace u polarizovaného světla. Podle směru, kterým rovinu stáčí, se rozlišují optické izomery (+) a (−). Nezaměňovat s příslušností k L- a D- řadám! Některé látky mají izomery L(+) a D(-), jiné naopak. Který případ nastává u konkrétní látky, se zjišťuje měřením.
Náboj
Každá aminokyselina (kromě prolinu) obsahuje aspoň dvě skupiny schopné disociace: -COOH a -NH2 a tvoří konjugovanou zásadu -COO− a konjugovanou kyselinu -NH3+.
V roztoku jsou kyselina i její konjugovaná zásada v protonové rovnováze:
- R-COOH ↔ R-COO− + H+
- R-NH2 + H+ ↔ R-NH3+
Jak se ustaví rovnováha, záleží na pH prostředí, tedy na koncentraci protonů v okolí. Karboxylová skupina je silnější kyselina a proton snadněji odštěpuje než přijímá.
Při nízkém pH, kdy je koncentrace vodíkových iontů v roztoku vysoká, skupina NH2 váže proton. Při stoupajícím pH se nejprve uvolní proton vázaný v karboxylové skupině, protože ta má menší disociační konstantu: při pH krve (7,4) nebo cytoplasmy (7,1) existuje karboxylová skupina pouze jako karboxylátový ion R-COO−, zatímco aminoskupina je protonovaná kyselina R-NH3+. Vzniká tak amfion, obojetný ion, který nese kladný i záporný náboj.
Teprve je-li pH vysoké, uvolní se proton i z aminoskupiny a obě dvě funkční skupiny se nachází ve stavu konjugované zásady.
Izoelektrický bod
Izoelektrický bod je taková hodnota pH, při které má daná aminokyselina nulový volný elektrický náboj – nachází se ve formě amfiontu, který se nepohybuje v elektrickém poli. Izoelektrické pH u aminokyselin, které mají dvě disociovatelné skupiny, leží uprostřed hodnot pK na obou stranách izoiontového uspořádání:
Situace je složitější u aminokyselin, které kromě alfa-karboxylové a alfa-aminové skupiny obsahují i jiné funkční skupiny, například kyselina asparagová, lysin nebo tyrosin.
Rozpustnost
Aminokyseliny se snadno rozpouštějí v polárních rozpouštědlech (voda, ethanol), v nepolárních rozpouštědlech jsou nerozpustné.
Peptidová vazba a reakce aminokyselin
Vznik peptidové vazby je reakce, při které reagují alfa-karboxylová skupina jedné aminokyseliny s alfa-aminovou skupinou druhé za odštěpení molekuly vody. Toto řetězení aminokyselin je principem spojování v peptidy a dále v proteiny (bílkoviny). Je to nejdůležitější reakce aminokyselin. K jejímu uskutečnění je třeba dodat energii.
Aminokyseliny mohou podstupovat stejné reakce jako kyseliny organické, ovšem v těle se nejčastěji účastní biosyntéz – ať už proteinů, glukosy či dusíkatých bází. Specifické reakce týkající se pouze aminokyselin jsou transaminace a deaminace (viz metabolismus).
Aminokyseliny se prokazují reakcí s ninhydrinem nebo fluorescaminem. Ninhydrin dekarboxyluje aminokyseliny na oxid uhličitý, amoniak a aldehyd, redukovaný ninhydrin pak reaguje se vzniklým amoniakem za vzniku modrého komplexu. Tato reakce je základem kvantitativního stanovení aminokyselin. Fluorescamin je citlivější činidlo, které umožňuje odhalit i nanogramová množství aminokyselin.
Proteinogenní aminokyseliny
Až na nepatrné výjimky jsou všechny proteiny ve všech živých organismech sestaveny z pouhých 19 druhů primárních aminokyselin (obsahujících primární aminové skupiny) a jedné sekundární aminokyseliny (obsahuje pouze sekundární aminovou skupinu), prolinu. Ty se obvykle označují jako biogenní nebo také proteinogenní aminokyseliny. Dále ještě existují 21. a 22. aminokyselina (selenocystein a pyrolysin), které se ovšem vyskytují vzácně a 23. aminokyselina N-formylmethionin využívaná bakteriemi místo methioninu pro iniciaci translace.
Posloupnost (sekvence) těchto aminokyselin určuje primární strukturu proteinu. Sekundární struktura proteinu je také do velké míry závislá na přítomnosti jistých aminokyselin – cystein pro tvorbu disulfidických můstků, prolin pro větší rigiditu či nutnost zhruba 33% zastoupení glycinu v kolagenu pro správné svinutí kolagenní fibrily.
Sekvence aminokyselin v proteinech je kódována v deoxyribonukleové kyselině – DNA. Každá aminokyselina je v genetickém kódu kódována jedním či více triplety bází a na pořadí těchto tripletů v DNA pak závisí pořadí aminokyselin v proteinu. Z cytoplazmy jsou dopravovány k ribozomu aminokyseliny navázané na transferovou RNA (tRNA), a to pomocí enzymů aminoacyl-tRNA syntetáz, přičemž každá z aminokyselin má vlastní specifickou tRNA a specifickou syntetasu. Kombinací těchto 20 (ve skutečnosti 23) proteinogenních aminokyselin jsou tvořeny všechny známé bílkoviny.
Jiné typy aminokyselin mohou být do biopolymerů připojeny jinými mechanismy, například při syntéze bakteriální buněčné stěny[1] nebo některých antibiotik (například gramicidinu). Proteinogenní aminokyseliny mohou být po připojení do proteinů posttranslačně modifikovány, takže proteiny často obsahují aminokyseliny chemicky odlišné od základních, které jsou zapojeny během syntézy.
Seznam proteinogenních aminokyselin
- Aminokyseliny s alifatickým postranním řetězcem
- S karboxylovou nebo amidovou skupinou na postranním řetězci (kyselé skupiny)
- Kyselina asparagová Asp (D)
- Asparagin Asn (N)
- Kyselina glutamová Glu (E)
- Glutamin Gln (Q)
- S aminovou skupinou na postranním řetězci (basické skupiny)
- S aromatickým jádrem nebo hydroxylovou skupinou na postranním řetězci
- Se sírou v postranním řetězci
- Aminokyseliny obsahující sekundární amin (někdy nepřesně iminokyseliny)
- Prolin Pro (P)
- 21. aminokyselina
- Selenocystein Sec (příp. SeCys) – nahrazuje cystein v lidském enzymu glutathionperoxidáze a v enzymech některých bakterií[2]
- 22. aminokyselina
- Pyrolysin Pyl – vyskytuje se zejména u prokaryot.
- 23. aminokyselina
- N-formylmethionin (fMet, HCO-Met, For-Met) – hraje roli při iniciaci translace u bakterií a na plastidových a mitochondriálních ribozomech, je tedy první aminokyselinou zařazenou při tvorbě proteinu. Často bývá posttranslačně odstraněna.
Neproteinogenní aminokyseliny
- Kyselina karbamová – nejjednodušší aminokyselina
- Taurin
- Thyroxin – hormon štítné žlázy
- Sarkosin
- Homoserin
- Homocystein
- Lanthionin
- Ethionin
- Kyselina 4-aminobenzoová
- Dehydroalanin
- Ornitin
- Citrulin
- Kyselina gama-aminomáselná
- Kyselina argininojantarová
- Hypoglycin
- Kreatin
Aminokyseliny v živých organismech
Aminokyseliny jsou součástí proteinů a peptidů, tedy strukturních bílkovin, enzymů i mnoha hormonů. To ale není jejich jediná funkce, jsou potřeba jako dárci uhlíkových řetězců k syntéze porfyrinů, purinů nebo pyrimidinů, přímo se účastní syntézy močoviny. Jejich deriváty, biogenní aminy, slouží kromě jiného jako neurotransmitery při nervovém přenosu (dopamin, noradrenalin aj.) nebo jako látky, které ovlivňují růst buněk (spermin, spermidin). Rozkladem některých aminokyselin v odumřelých tělech organismů vznikají tzv. mrtvolné jedy – páchnoucí látky putrescin a kadaverin.
Vstřebávání a metabolismus aminokyselin
Jedno z dělení aminokyselin je dělení na esenciální a nonesenciální (někdy neesenciální) v závislosti na schopnosti těla danou aminokyselinu syntetizovat. Existuje osm esenciálních aminokyselin, ovšem některé z nonesenciálních (arginin a histidin) jsou esenciálními pro rostoucí organismus, jiné (např. cystein) vznikají z aminokyselin esenciálních. Proto je nutné aminokyseliny (potažmo proteiny) přijímat potravou. Udává se, že denní bílkovinné minimum je okolo 80 gramů.
Proteiny jsou v GIT štěpeny jednak volnými enzymy (pepsin, trypsin aj.), ale také enzymy vázanými přímo na membránu enterocytů. Jednotlivé aminokyseliny jsou potom resorbovány do krve a mohou být použity buď pro různé biosyntézy, nebo vstupují do katabolismu.
Podle konečných metabolitů můžeme aminokyseliny rozdělit na glukogenní (tedy takové, jejichž metabolity mohou být použity pro syntézu glukózy) a ketogenní (tedy takové, z jejichž metabolitů vznikají ketolátky). Toto dělení je poněkud narušeno faktem, že isoleucin, lysin, fenylalanin, tryptofan a tyrosin jsou jak glukogenní, tak ketogenní. Katabolismus uhlíkového řetězce aminokyseliny je komplexní proces, jehož úplný popis je nad rámec tohoto článku, takže zde bude pouze nárys: celý proces začíná odstraněním α-aminodusíku (obvykle transaminací), načež je částečně oxidovaný řetězec degradován na amfibolické intermediáty (acetyl-CoA, citrát, α-ketoglutarát, sukcinyl-CoA, fumarát, oxalacetát, acetacetyl-CoA). Aminokyseliny je možné také dělit podle toho, na jaký intermediát je degradována (dělení je opět narušeno např. isoleucinem, který se může degradovat jak na Acetyl-CoA tak na sukcinyl-CoA). Tyto intermediáty mohou být buďto zpracovány citrátovým cyklem, nebo použity v anabolismu.
Dusík, který byl z aminokyseliny odstraněn, musí být využit – nebo vyloučen, protože běžný dospělý organismus udržuje vyváženou dusíkovou bilanci (přijímá a vylučuje stejně dusíku – který je zejména v aminokyselinách).
Prvním krokem je transaminace: α-aminoskupina se přenese pomocí specifické transaminasy na α-ketokyselinu (obvykle α-ketoglutarát), čímž vznikne odpovídající α-ketokyselina a L-glutamát (kyselina glutamová, jedna z nonesenciálních aminokyselin). Je-li třeba zbavovat se dusíku, L-glutamát se cestou oxidativní deaminace mění zpět na α-ketoglutarát za vzniku amoniaku. Vzniklý amoniak je nutno vyloučit z těla, neboť se jedná o látku toxickou. Podle způsobu vylučování dusíku se organismy dělí na amonotelní (vylučují přímo amoniak – například ryby), urikotelní (vylučují kyselinu močovou – například ptáci) a ureotelní (vylučují močovinu – většina suchozemských živočichů, včetně člověka). Močovina vzniká v ureosyntetickém cyklu, kde mj. vzniká aminokyselina arginin a figurují zde dvě další aminokyseliny, které ovšem nejsou proteogenní – ornithin a citrulin. Ureosyntetický cyklus probíhá pouze v játrech, v jiných tkáních probíhají alternativní metody detoxikace amoniaku (syntéza glutaminu z glutamátu, glukosový-alaninový cyklus).
Poruchy metabolismu aminokyselin jsou příčinou některých vrozených chorob, jako je fenylketonurie, tyrosinóza nebo nemoc javorového sirupu. Defekt v ureosyntetickém cyklu může vést k smrtelným onemocněním jako hyperamonémie či argininsukcináturie nebo i jiným, méně závažným chorobám.
Odkazy
Reference
- ↑ HEIJENOORT, J. v. Formation of the glycan chains in the synthesis of bacterial peptidoglycan. Glycobiology. 2001-03-01, roč. 11, čís. 3, s. 25R–36R. DOI 10.1093/glycob/11.3.25R.
- ↑ KODÍČEK, M. selenocystein. From Biochemické pojmy : výkladový slovník [online]. Praha: VŠCHT Praha, 2007 [cit. 2008-10-21]. Dostupné z http://vydavatelstvi.vscht.cz/knihy/uid_es-002/ebook.html?p=selenocystein
Literatura
- MURRAY, Robert K. a kolektiv – Harperova Biochemie, ISBN 80-7319-013-3
- GANNONG, William F. – Přehled lékařské fyziologie, ISBN 80-7262-311-7
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu aminokyselina na Wikimedia Commons
Obrázky, zvuky či videa k tématu aminokyselina na Wikimedia Commons  Galerie aminokyselina na Wikimedia Commons
Galerie aminokyselina na Wikimedia Commons Slovníkové heslo aminokyselina ve Wikislovníku
Slovníkové heslo aminokyselina ve Wikislovníku
Média použitá na této stránce
Fenilalaninaren egitura kimikoa.
Asparaginaren egitura kimikoa.
Alaninaren egitura kimikoa.
Balinaren egitura kimikoa.
Zisteinaren egitura kimikoa.
Histidinaren egitura kimikoa.
Lisinaren egitura kimikoa.
Glutaminaren egitura kimikoa.
pyrrolysine
Autor: User:Ppfk, Licence: CC BY-SA 3.0
Estrutura geral de um aminoácido
Triptofanoaren egitura kimikoa.
Leuzinaren egitura kimikoa.
Azido aspartikoaren egitura kimikoa.
Metioninaren egitura kimikoa.
Serinaren egitura kimikoa.
Azido glutamikoaren egitura kimikoa.