Amyloid beta
Amyloid beta (Aβ) je hlavní složkou senilních plaků a neurofibrilárních klubek, které byly nalezeny v mozku pacientů s Alzheimerovou chorobou (AD). Jeho význam mohl ale nadsadit vědecký podvod.[1] Jedná se o vláknitý bílkovinný agregát nejčastěji složený z 36-43 aminokyselin, patřící do skupiny missfoldních proteinů. Dříve byla nejvíce věnována pozornost neurofibrilárním formám Aβ, dnes díky studiím a experimentům jsou to rozpustné oligomerní struktury Aβ, které mohou hrát důležitou fyziologickou roli při vzniku AD. Jejich toxicita je především spojena s agregačním procesem vedoucím k oligomerům a fibrilám, které jsou toxické pro nervové buňky a rezistentní k enzymatickému odbourávání. Je tvořen enzymatickým štěpením APP (amyloidní prekurzorový protein) ve dvou isoformách 1-40 a 1-42.
Vznik
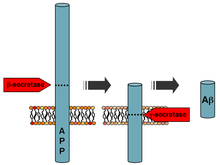
Amyloid beta vzniká štěpením tzv. amyloidového prekurzorového proteinu (APP) tzv. amyloidogenní cestou.[2] APP je štěpen nejprve enzymem β-sekretázou (BECE-1) (transmembránová aspartyl-proteáza), čímž vzniká N-terminální fragment o menší délce (sAPP-β) a membránově vázaný C-terminální konec (CTFβ)(99 aminokyselin). Štěpení se provádí blíže k N-terminálnímu konci APP, který s α-sekretázou tvoří CTFβ delší než CTFα. CTFβ je štěpen γ-sekretázou, která odštěpuje peptidy o délce 37-43 aminokyselin - amyloid beta (Aβ).
Tvorba fibril
Aβ jsou považovány za finální fibrilární formu v β struktuře, vznikající polymerizačním procesem v jádře. Jedná se o misfoldní, tedy špatně prostorově složený protein. Ke vzniku amyloidu dochází agregací původně rozpustné formy proteinu s primárně nebo sekundárně výrazně zastoupenou beta strukturou do formy fibrilární. Vzniklé fibrily se skládají z úseků β, kde jednotlivé řetězce jsou navzájem uspořádány antiparalelně a leží kolmo na dlouhou osu vlákna. Utváření Aβ je charakteristické třemi fázemi.
- Pomalá nukleační fáze: Díky konformačnímu přechodu rozpustného prekurzoru dochází ke tvorbě jader náchylných k agregaci. Tyto globulární fragmenty se v průběhu času formují do protofilament.
- Fáze růstu: V této fázi se jádra formují do polymerů. Tento děj nastává v momentě, kdy koncentrace dosáhne kritických hodnot. Koncentrace může být snížena v intervalu před začátkem formování Aβ22. Dimer je základní formací vedoucí ke vzniku protofilament. Přirozeně se vyskytující rozpustná forma musí projít konformační změnou zahrnující záhyb Gly25 a tvorbu intramolekulárního beta-skládaného listu před agregací. Sekvence 4Gly zbytků (G25, G29, G33, G37) je destabilizující pro alfa-helix, ale stabilizuje zabalení do beta-listu. Vlásenka monomeru Aβ je stabilizována solnými můstky mezi D23 a K2818. Agregáty Aβ od velikosti dimerů po mnohem vyšší polymery s vyšší molekulovou hmotností jsou předchůdci prstencových protofilament, ze kterých dále vznikají fibrily.
- Ustálená fáze: Monomery a fibrily jsou v dynamické rovnováze.[3]
Amyloid beta a cholesterol
Transport cholesterolu z periferní cirkulace do mozku je obvykle bráněn hematoencefalickou bariérou, která obvykle odděluje periferní a centrální regulaci cholesterolu. Nicméně když je integrita této bariéry ohrožena cévním poraněním, regulovaný vstup cholesterolu do mozku může být snížen. Důsledky cévního poranění na bariéru nejsou zcela známy, ale následkem může být zvýšená akumulace membránového cholesterolu, což vyvolá nepříznivou interakci mezi cholesterolem a sekretasou, která metabolizuje Aβ.
Cholesterol ovlivňuje aktivitu enzymů zapojených do metabolismu proteinů APP. Studie na zvířatech prokázala, že cholesterol zrychluje ukládání Aβ v mozku, statiny (léky sloužící k léčbě hypercholesterolemie) mohou tento proces ovlivnit. Další [in vivo] studie prokázaly, že vysoká hladina cholesterolu může snížit produkci rozpustných APP. Vysoký obsah cholesterolu v membráně neuronů, podpoří soustředění γ a β sekretas, čímž usnadní negativní štěpení APP. Aβ peptidy mohou být nepřímo ovlivněny endogenními lipidy díky jejich interakci s redoxními kovy, generováním reaktivních forem kyslíku. Existují epidemiologická data, která poukazují na vztah mezi cholesterolem a AD. Průřezové analýzy popsaly aterosklerózu, pro kterou je hypercholesterolémie důležitým rizikovým faktorem. Studie dále ukázaly na vztah mezi zvýšenou hladinou cholesterolu ve středním věku a kognitivní poruchou v pozdním věku nebo AD.
Pravděpodobnost vzniku AD byla o 60-73 % nižší ve skupině pacientů, kteří užívali statiny. Další studie ukázala, že vznik demence byl až o 70 % nižší u pacientů, kteří užívali statiny, než u pacientů u kterých byla hyperholesterolemie léčena jinými medikamenty. Zdá se tedy, že nízká hladina cholesterolu inhibuje amyloidogenní cestu (štěpení β- a γ-sekretasou), zatímco stimuluje neamyloidogenní cestu (štěpení α-sekretasou).[4]
Odkazy
Reference
- ↑ https://www.seznamzpravy.cz/clanek/tech-technologie-veda-vedecky-podvod-stoleti-manipulace-ve-slavne-studii-unikaly-pozornosti-15-let-209908 - Vědecký podvod století? Manipulace ve slavné studii unikaly pozornosti 15 let
- ↑ Amyloidogenic glycoprotein, amyloid-beta peptide (IPR013803) [online]. EMBL-EBI, 2014. Dostupné online.
- ↑ MUŇOZ. Protein Folding, Misfolding and Aggregation. [s.l.]: Royal Society of Chemistry, 2008. Dostupné online. S. 214-224.
- ↑ Kristofikova Z., Kriz Z., Sirova J. , Ripova D., "Can stereospecificity in interactions of monomeric amyloid beta peptides reflect their physiological function?", 2013, s. 1–10
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Amyloid beta na Wikimedia Commons
Obrázky, zvuky či videa k tématu Amyloid beta na Wikimedia Commons
Média použitá na této stránce
Depiction of en:amyloid precursor protein processing, created by I. Peltan Ipeltan
