Arylhalogenidy
Arylhalogenidy (také nazývané halogenareny) jsou organické sloučeniny, které mají v molekule alespoň jeden atom halogenu navázaný přímo na aromatické jádro. Od halogenalkanů se výrazně liší způsobem přípravy i mnoha vlastnostmi. Největší využití z nich mají arylchloridy, používají se ovšem i ostatní.
Příprava
Existují dva hlavní způsoby přípravy arylhalogenidů: přímou halogenací a přes diazoniové soli.[1]
Přímá halogenace
Při Friedelově–Craftsově halogenaci se na aromatické jádro připojuje halogen za katalýzy Lewisovou kyselinou, což obvykle bývají chloridy kovů, jako například chlorid železitý a chlorid hlinitý. Tímto způsobem se získává například chlorbenzen, což je nejpoužívanější arylhalogenid. Při výrobě monochlorbenzenu vznikají jako vedlejší produkty také dichlorbenzeny.[2]
Areny se skupinami dodávajícími elektrony mohou reagovat s halogeny i za nepřítomnosti Lewisových kyselin. Příkladem jsou fenoly a aniliny, které rychle reagují s chlorovou či bromovou vodou za vzniku vícenásobně halogenovaných produktů.[3] Odbarvení bromové vody areny s vysokou elektronovou hustotou se používá k důkazu jejich přítomnosti ve vzorku.
Přímou halogenaci arenů lze provést na světle nebo za vysokých teplot. U alkylbenzenů se při radikálové halogenaci přednostně halogenují alkylové skupiny, k halogenaci aromatického jádra jsou potřeba Lewisovy kyseliny a přítomnost světla, které zamezuje vedlejším reakcím.[1]

Sandmeyerova, Balzova-Schiemannova a Gattermannova reakce
Druhým hlavním způsobem přípravy a výroby arylhalogenidů je Sandmeyerova reakce. Nejprve se aniliny (arylaminy) za přítomnnosti dusitanu a kyseliny přeměňují na diazoniové soli, u nich se následně provede samotná Sandmeyerova reakce, kdy reagují s měďným halogenidem na příslušný arylhalogenid, například s chloridem měďným vznikají arylchloridy. Odcházející skupinou je plynný dusík, díky čemuž je rovnováha reakce výrazně posunuta směrem k produktům. Při podobné Balzově–Schiemannově reakci se používají tetrafluorboritany jako zdroj fluoridových iontů. K přeměně diazoniových solí na chlorareny či bromareny je také možné použít Gattermannovu reakci, při které se místo měďných halogenidů používá prášková měď za přítomnosti HCl nebo HBr.
Výskyt
Arylhalogenidy se také vyskytují v přírodě, nejčastěji v mořských organismech, které získávají chlor a brom z vody. Jedná se o řadu sloučenin, jako jsou deriváty tyrosinu, tryptofanu a pyrrolu. Některé z těchto arylhalogenidů se používají jako léčiva.[4][5]

Struktura
Délka vazby uhlík-halogen je u fluorbenzenu, chlorbenzenu, brombenzenu a methyl-4-jodbenzoátu postupně 135,6(4), 173,90(23), 189,8(1) a 209,9 pm.[6]
Reakce
Substituce
Arylhalogenidy se od alkylhalogenidů liší tím, že u nich neprobíhají klasické SN2 reakce, jelikož kvůli rovinnému tvaru molekuly nemohou být atakovány zezadu, což je pro průběh SN2 reakce nutné. SN1 reakce by teoreticky probíhat mohly, ovšem obvykle k nim nedochází, jelikož tvorba arylového kationtu není energeticky výhodná.
Arylhalogenidy se skupinami odtahujícími elektrony v polohách ortho a para mohou podstoupit SNAr reakce, například 2,4-dinitrochlorbenzen reaguje s vodou v zásaditém prostředí za vzniku fenolu:
Na rozdíl od mnoha jiných substitučních reakcí je zde nejlépe reagující skupinou fluorid a nejhůře reaguje jodid, vzhledem k vysoké elektronegativitě fluoru, která vede k větší stabilizaci přechodného stavu, ze kterého se tvoří Meisenheimerův meziprodukt. Pro odstranění aktivní kyslíkaté odcházející skupiny byl v roce 2016 navržen soustředěný mechanismus. V tomto mechanismu je Meisenheimerův meziprodukt v podstatě jen přechodným stavem namísto skutečného meziproduktu.[7] V roce 2018 se ukázalo, že k SN1 reakcím dochází častěji, než se předpokládalo, a to v některých případech, ve kterých byl očekáván SNAr mechanismus.[8]
Substituce s benzynovým mechanismem
Arylhalogenidy lze za přítomnosti amidu sodného v kapalném amoniaku přeměnit na odpovídající aminy, například chlorbenzen na anilin; tato reakce probíhá přes benzynový meziprodukt.
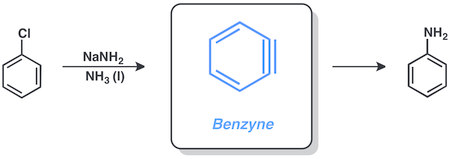
Tvorba organokovových sloučenin
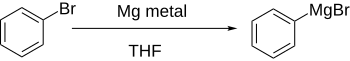
Arylhalogenidy reagují s kovy jako jsou lithium a hořčík za vzniku reaktivních produktů, které mohou být zdroji arylových aniontů.
Přímá tvorba Grignardových činidel se provádí reakcí hořčíku s arylhalogenidem v diethyletheru; pokud není aromatické jádro deaktivováno skupinami odtahujícími elektrony, tak probíhá snadno.
Ze sloučenin jako je p-bromnitrobenzen nelze přímou reakcí získat stabilní Grignardova činidla, protože jsou jejich aromatická jádra příliš deaktivovaná. V takových případech se obvykle připravují pomocí reakce s isopropylmagnesiumchloridem při -78 °C. Reakce probíhá díky tomu, že pKa aromatických protonů je nižší oproti alifatickým protonům (přibližně 45 místo 50). Takto získaná Grignardova činidla se používají ihned po přípravě, aby se zabránilo jejich rozkladu.
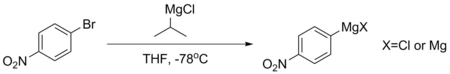
Biologický rozklad
Bakterie Rhodococcus phenolicus dokáže získávat uhlík z dichlorbenzenu.[9]
Ostatní reakce
Atomy halogenů mohou být pomocí silných nukleofilů odstraněny reakcemi, při kterých se tvoří radikálové anionty. Obzvláště u bromidů a jodidů také může proběhnout oxidační adice, jako je Buchwaldova–Hartwigova aminace.
Chlorbenzen se používal na výrobu fenolu, který se v současnosti vyrábí oxidací kumenu. Za vysokých teplot lze reakcemi arylhalogenidů s amoniakem získat aniliny.[2]
Použití
Nejčastěji vyráběnými arylhalogenidy jsou chlorbenzen a jednotlivé izomery dichlorbenzenu. Chlorbenzen se používají jako rozpouštědlo herbicidu Lasso. Od 80. let 20. století se výroba arylhalogenidů snižuje.[2]
Z chlorbenzenu se vyrábí trifenylfosfin:
- 3 C6H5Cl + PCl3 + 6 Na → P(C6H5)3 + 6 NaCl
Arylbromidy se používají jako zpomalovače hoření, nejpoužívanější z nich je tetrabrombisfenol A, který se vyrábí přímou bromací bisfenolu.[10]
Reference
V tomto článku byl použit překlad textu z článku Aryl halide na anglické Wikipedii.
- ↑ a b Robert W. Boyd; Robert Morrison. Organic chemistry. Englewood Cliffs, N.J.: Prentice Hall, 1992. Dostupné online. ISBN 978-0-13-643669-0. S. 947.
- ↑ a b c U. Beck; E. Löser. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: [s.n.], 2011. ISBN 978-3527306732. doi:10.1002/14356007.o06_o03. Kapitola Chlorinated Benzenes and Other Nucleus-Chlorinated Aromatic Hydrocarbons.
- ↑ EDWARD R. ATKINSON; DONALD M. MURPHY; JAMES E. LUFKIN. dl-4,4',6,6'-Tetrachlorodiphenic Acid. Org. Synth.. 1951. Dostupné online.; Coll. Vol.. S. 872.
- ↑ Danica Galonić Fujimori; Christopher T. Walsh. What's new in enzymatic halogenations. Current Opinion in Chemical Biology. 2007, s. 553–560. doi:10.1016/j.cbpa.2007.08.002. PMID 17881282.
- ↑ Gordon W. Gribble. Natural Organohalogens: A New Frontier for Medicinal Agents?. Journal of Chemical Education. 2004, s. 1441. doi:10.1021/ed081p1441. Bibcode 2004JChEd..81.1441G.
- ↑ Heinz Oberhammer. PATai's Chemistry of Functional Groups. [s.l.]: [s.n.], 2009. ISBN 978-0-470-68253-1. Kapitola The Structural Chemistry of Carbon-Halogen Bonds, s. 947.
- ↑ Tobias Ritter; Jacob M. Hooker; Constanze N. Neumann. Concerted nucleophilic aromatic substitution with 19F− and 18F−. Nature. 2016, s. 369–373. ISSN 1476-4687. doi:10.1038/nature17667. PMID 27281221.
- ↑ Eric N. Jacobsen; Harrison A. Besser; Yuwen Zeng; Eugene E. Kwan. Concerted nucleophilic aromatic substitutions. Nature Chemistry. 2018, s. 917–923. ISSN 1755-4349. doi:10.1038/s41557-018-0079-7. PMID 30013193.
- ↑ Marc Rehfuss; James Urban. Rhodococcus phenolicus sp. nov., a novel bioprocessor isolated actinomycete with the ability to degrade chlorobenzene, dichlorobenzene and phenol as sole carbon sources. Systematic and Applied Microbiology. 2005, s. 695–701. doi:10.1016/j.syapm.2005.05.011. PMID 16261859.
- ↑ D. Ioffe; A. Kampf. Kirk-Othmer Encyclopedia of Chemical Technology. [s.l.]: [s.n.], 2002. ISBN 978-0471238966. doi:10.1002/0471238961.0218151325150606.a01. Kapitola Bromine, Organic Compounds.
Média použitá na této stránce
Chemical structure of vancomycin
Autor: NSEasternShoreChemist, Licence: CC0
The formation of phenylmagnesium bromide in THF.
Chemical diagram showing halogenation of benzene with generic halogen
Autor: NSEasternShoreChemist, Licence: CC BY-SA 4.0
Magnesium halogen exchange, using i-PrMgCl, in THF






