Atomární uhlík
| Atomární uhlík | |
|---|---|
| Obecné | |
| Systematický název | methandiyliden |
| Ostatní názvy | λ0-methan |
| Sumární vzorec | C |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| PubChem | 5462310 |
| ChEBI | 27594 |
| SMILES | [C] |
| InChI | 1S/C |
| Vlastnosti | |
| Molární hmotnost | 12,011 g/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Atomární uhlík, systematickým názvem λ0-methan nebo methandiyliden je bezbarvá anorganická plynná látka se vzorcem C. Za standardních podmínek je kineticky nestabilní a podléhá autopolymerizaci. Lze jej považovat za monomer grafitu.
Vlastnosti
Amfoterita
Atomární uhlík může reagovat s Lewisovou kyselinou, která se může spojit s elektronovým párem uhlíku, také může elektronový pár Lewisovy kyseliny reagovat s uhlíkem:
[2]::[C] + M → [MC]
- [C] + :L → [CL]
Vzhledem k této schopnosti přijímat či odevzdávat elektrony je atomární uhlík Lewisova amfoterní látka.[3]
Atomový uhlík může Lewisovým kyselinám dodat či od nich převzít až dva elektronové páry. Může být též protonován:
- C + H+ → CH+
Tento záchyt protonu znamená, že je atomární uhlík též Brønstedova–Lowryho zásada. Jeho konjugovanou kyselinou je λ2-methylium (CH+).
Vodné roztoky aduktů jsou ovšem nestabilní, jelikož dochází k hydrataci uhlíkového centra a λ2-methyliové skupiny za vzniku λ2-methanolu (CHOH), λ2-methanu (CH2) nebo hydroxymethyliové skupiny (CH2OH+). λ2-methanolová skupina se může polymerizovat na formaldehyd, či se dále hydratovat na dihydroxymethylium (CH(OH) +
2 a nebo reagovat s vodou na formylium (HCO+).[2]
Elektromagnetické vlastnosti
Elektrony jsou v atomovém uhlíku rozděleny podle výstavbového principu, čím vznikají různé kvantové stavy, každý s jinou energetickou úrovní. Nejnižší energii má základní stav, což je tripletový diradikálový stav (3P0). První dva excitované stavy mají poměrně podobné energie, jde o singletový (1D2) a singletový diradikálový (1S0) stav. Neradikálová forma atomárního uhlíku se nazývá λ2-methyliden, diradikálový stav má systematický název λ2-methandiyl.
Stavy 1D2 a 1S0 mají energii oproti základnímu stavu vyšší o 121,9 a 259,0 kJ mol−1. K přechodům mezi těmito stavy obvykle nedochází, protože je k tomu nutná změna spinu nebo spárování elektronů, což vede k fosforescenci na vlnové délce 981,1 nm, tedy v blízké infračervené oblasti. Po excitaci ultrafialovým zářením může také dojít k fluorescenci na 873,0 nm, tedy v infračerveném záření, a k fosforescenci na 461,9 nm (v modrém světle).
Příprava
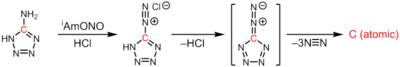
Atomární uhlík se připravuje průchodem velkého elektrického proudu mezi dvěma uhlíkovými tyčemi, čímž se vytvoří elektrický oblouk. Způsob přípravy této látky je podobný přípravě fullerenu C60, rozdíl spočívá hlavně v použití mnohem tvrdšího vakua. Samotný atomární uhlík vzniká termolýzou 1H-tetrazol-5-aminu, přičemž se odštěpují 3 ekvivalenty molekulárního dusíku:[4]
CN6 → :C: + 3N2
Zdrojem atomárního uhlíku může být také rozklad karbidu tantalu.[5] Při tomto procesu se nejprve vloží uhlík do tenkostěnné nádoby z tantalu. Po uzavření této nádoby dochází k zahřívání stejnosměrným elektrickým proudem. Solvatované atomy uhlíku difundují k vnějšímu povrchu nádoby a po dosažení určité teploty se z povrchu nádoby začne odpařovat atomární uhlík. Tímto postupem vznikají atomy uhlíku bez příměsí dalších látek.
Dekarbonylace suboxidu uhlíku
Další možnou metodou přípravy atomárního uhlíku je dekarbonylace suboxidu uhlíku. Při tomto postupu se suboxid uhlíku rozkládá na atomový uhlík a oxid uhelnatý podle následující rovnice:
- C3O2 → 2 CO + [C]
Při tomto postupu se vytváří meziprodukt, kterým je monoxid diuhlíku, reakce probíhá ve dvou krocích, přičemž je u každého potřeba ozářit reakční směs tvrdým ultrafialovým zářením.
- OCCCO → [CCO] + CO
- [CCO] → CO + [C]
Reakce
Protože je atomární uhlík látkou s nedostatkem elektronů, tak podléhá samovolné polymerizaci a také vytváří adukty s Lewisovými kyselinami a zásadami. Oxidací z něj vzniká oxid uhelnatý, redukcí λ2-methan. Nekovy, jako je kyslík, s atomárním uhlíkem reagují za vzniku sloučenin s dvojvazným uhlíkem:
2 [C] + O2 → 2 CO
Atomární uhlík je velmi reaktivní, většina jeho reakcí je značně exotermní. Většinou se provádějí v plynné fázi za teploty kapalného dusíku (77 K). Příklady takových reakcí jsou:[6]
- Připojení na vazbu C-H v alkanech za vzniku karbenů.
- Deoxygenace karbonylových sloučenin za vzniku karbenů, například z butanonu vzniká butan-2-yliden.
- Připojení na dvojnou vazbu mezi uhlíky za vzniku cyklopropylidenu, u něhož dochází k otevírání cyklu, z alkenů se takto tvoří kumuleny.
Reference
V tomto článku byl použit překlad textu z článku Atomic carbon na anglické Wikipedii.
- ↑ a b Methane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b D. Husain; L. J. Kirsch. Reactions of Atomic Carbon C(23PJ) by Kinetic Absorption Spectroscopy in the Vacuum Ultra-Violet. Transactions of the Faraday Society. 1971, s. 2025–2035. DOI 10.1039/TF9716702025.
- ↑ Catherine E. Housecroft; Alan G. Sharpe. Inorganic Chemistry. [s.l.]: Pearson Education, Ltd., 2012. (4). ISBN 978-0-273-74275-3. Kapitola Acids, bases and ions in aqueous solution, s. 227.
- ↑ Philip B. Shevlin. Formation of atomic carbon in the decomposition of 5-tetrazolyldiazonium chloride. Journal of the American Chemical Society. 1. 5. 2002, s. 1379–1380.
- ↑ S. A. Krasnokutski; F. Huisken. A simple and clean source of low-energy atomic carbon. Applied Physics Letters. 15. 9. 2014, s. 113506. Bibcode 2014ApPhL.105k3506K.
- ↑ Reactive Intermediate Chemistry, Robert A. Moss, Matthew S. Platz and Maitland Jones Jr., Wiley-Blackwell, (2004), ISBN 978-0471233244
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances