Atomové spektrum

Atomové spektrum (také optické spektrum atomu) je spektrum pohlcené nebo vyzářené jedním atomem. Tato spektra jsou pro atomy chemických prvků charakteristická a jedinečná.[1]
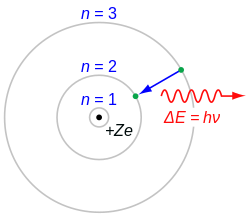
Jednotlivé spektrální čáry atomového spektra odpovídají energetickému rozdílu mezi dvěma různými stavy (hladinami) atomu - základním a excitovaným. Přechod mezi nimi může nastat absorbováním elektromagnetického záření (fotonu) a následně zpětnou emitací fotonu se stejnou energií.
Platí, že pokud je látka ozářena elektromagnetickým zářením, jsou absorbovány pouze určité vlnové délky, vlnová čísla a určité energie. Atom totiž absorbuje pouze fotony, jejichž energie odpovídá přechodu mezi energetickými hladinami v atomu. Atomové spektrum se dělí na:

- Absorpční spektrum - záření, které atom absorbuje (pohltí). Absorpční spektra prvků a jednoduchých látek jsou obvykle tvořena sadou tmavých spektrálních čar na barevném pozadí celého spektra.

Emisní spektrum vodíku - Emisní spektrum - záření, které atom emituje (vysílá). Emisní spektra prvků a jednoduchých látek jsou obvykle tvořena sadou barevných spektrálních čar na tmavém pozadí.
- Platí, že tam kde se u emisního spektra nacházejí barevné spektrální čáry, jsou u absorpčního spektra tmavé čáry.
Energetické hladiny atomu

Energetické hladiny atomu (uspořádání elektronů uvnitř elektronového obalu) popisuje elektronová konfigurace atomu. Předpokládá se, že se elektrony převážně vyskytují v prostoru, který se nazývá atomový orbital (s, p, d, f). Energie orbitalu a vzdálenost orbitalu od atomového jádra je popsána hlavním kvantovým číslem n.[1]

Energetický rozdíl mezi hladinami atomu je diskrétní a může nabývat pouze hodnot daných elektronovou konfigurací atomu. Atom proto může absorbovat nebo emitovat pouze záření určitých diskrétních vlnových délek. Tyto vlnové délky jsou charakteristické pro atomy jednotlivých chemických prvků.
Po ozáření atomu elektromagnetickým zářením dochází k jeho excitaci pouze v případě, pokud energie záření odpovídá přechodu mezi energetickými hladinami elektronů. Rozdíl energií lze obecně popsat rovnicí:
Δ E = Eexcitovaný stav - Ezákladní stav = .
kde je Planckova konstanta (hodnota 6,6252×10−34 J·s = 4,1 μeV/GHz), (také se používá značka ) je frekvence záření (Hz)
Pro elektromagnetické záření o vlnové délce (m) (ve vakuu), které má frekvenci (Hz) a jemu připisovaný foton má energii (J) platí následující rovnice:
kde je rychlost světla (přibližně 2,998×108 m/s), je Planckova konstanta (hodnota 6,6252×10−34 J·s = 4,1 μeV/GHz)
Teorie
Při přechodech mezi energetickými hladinami atomu dochází k vyzáření nebo pohlcení fotonu. V Bohrově modelu je souvislost mezi spektrem a energetickými hladinami určena třetím postulátem, resp. vztahem
- ,
kde (také se používá značka ) je frekvence fotonu, je energie elektronu v počátečním stavu (stav s kvantovým číslem ) a je energie elektronu v konečném stavu (stav s kvantovým číslem ). Pohybuje-li se tedy elektron po stabilní dráze, nevyzařuje podle druhého postulátu žádné záření, při přechodu mezi jednotlivými drahami však dojde k vyzáření nebo pohlcení energetického kvanta, jehož velikost určuje právě uvedený vztah.
Podobné závěry lze získat také na základě kvantově mechanického modelu atomu.
Stav elektronu ve stavu s hlavním kvantovým číslem a energií určuje vlnová funkce . Přechod mezi dvěma stavy představuje změnu v čase, což vyžaduje časově závislou vlnovou funkci. Časově závislou vlnovou funkci však můžeme vyjádřit prostřednictvím časově nezávislé vlnové funkce jako
Pro střední hodnotu polohy elektronu (v daném stavu ) na ose x platí
Střední hodnota polohy elektronu ve stavu na ose x se tedy s časem nemění. Nedochází-li ke změně polohy, nedochází ani k vyzařování, tzn. elektron v určitém kvantovém stavu v tomto stavu zůstává.
Předpokládejme nyní, že atom přechází z počátečního stavu s vlnovou funkcí do stavu s vlnovou funkcí a zpět do původního stavu . Výslednou vlnovou funkci lze vyjádřit jako superpozici obou stavů, tzn.
- ,
kde jsou (komplexní) koeficienty.
Pravděpodobnost výskytu elektronu ve stavu určuje výraz a ve stavu výraz . Pokud předpokládáme, že se elektron nachází alespoň v jednom z obou stavů, pak musí platit podmínka . Na počátku celého procesu je a , v okamžiku přechodu do stavu platí a , a po skončení celého procesu je opět a .
Střední hodnota polohy elektronu je
Rozepsáním tohoto výrazu a vzhledem k tomu, že pro konečný vázaný systém dvou stavů platí a také , lze po úpravě vyjádřit střední hodnotu polohy ve tvaru
- ,
kde byla zavedena frekvence výrazem
Stavy jsou v průměru stacionární. Při přechodu mezi těmito stavy dochází k oscilacím střední polohy elektronu s frekvencí . Kvantová mechanika je tedy schopna pro frekvence přechodu určit uvedený vztah, který je shodný se vztahem známým z Bohrova modelu atomu, který však v Bohrově modelu atomu bylo nutné postulovat.
Spektrální čáry mohou vykazovat jemnou strukturu kvůli štěpení energetických hladin, tzn. sejmutí degenerace např. vzájemnou interakcí elektronů, relativistickými efekty a interakcí elektronů s magnetickým momentem jádra, u stavů, které by bez těchto efektů měly stejnou energii.
Výběrová pravidla
Přechod mezi dvěma stavy atomu závisí na veličině . Přechody, u nichž je příspěvek tohoto smíšeného členu nulový, nemohou nastat a proto se označují jako zakázané přechody. Přechody, u kterých je příspěvek tohoto smíšeného členu konečný a nenulový, se označují jako dovolené.
Z vlnové funkce atomu vodíku lze pro dovolené přechody odvodit následující pravidla.
kde je hlavní kvantové číslo, je vedlejší kvantové číslo a je magnetické kvantové číslo. Uvedené podmínky se označují jako výběrová pravidla.
Výběrová pravidla tedy říkají, že změna hlavního kvantového čísla není omezena, orbitální kvantové číslo se vždy mění o +1 nebo -1 a magnetické kvantové číslo se buď vůbec nemění, nebo se mění o +1 nebo -1.
Jednoelektronová spektra
Jednoelektronová spektra jsou spektra atomů, které mají ve vnější slupce pouze jeden elektron. Takové atomy jsou podobné atomu vodíku.
Výběrová pravidla pro takové atomy jsou
Dvouelektronová spektra
Dvouelektronová spektra jsou spektra atomů se dvěma elektrony ve vnější slupce. Příkladem takového atomu je helium. Celkový moment hybnosti vyšetřujeme prostřednictvím LS-vazby.
Výběrová pravidla pro dovolené přechody při LS-vazbě jsou určena vztahy
Rentgenová spektra
Při přechodech ve vnějších vrstvách elektronového obalu je hodnota vyzářené (pohlcené) energie relativně malá. Obvykle se pohybuje v řádech elektronvoltů. Vlnové délky fotonů, které spojujeme s takovými přechody obvykle leží v okolí viditelné oblasti spektra elektromagnetického záření.
Na jiné energetické hladiny však mohou přecházet nejen vnější elektrony, ale také elektrony nacházející se ve vnitřních vrstvách elektronového obalu. Na tyto elektrony působí elektrický náboj atomového jádra podstatně silněji, neboť nedochází k jeho stínění jinými (mezilehlými) elektrony. Energie potřebná k vytržení vnitřního elektronu z atomu je tedy mnohem vyšší (v řádech stovek i tisíců eV), především u těžkých atomů. Vysoké energie, které tyto přechody provází, mají za následek vznik diskrétních spektrálních čar, které se nachází v rentgenové oblasti spektra elektromagnetického záření. Z toho důvodu se označují jako rentgenová spektra.
Pokud dojde k vyražení vnitřního elektronu atomu, dochází poměrně záhy k přechodu některého z vnějších elektronů na uvolněné místo. Tento přechod je současně provázen rentgenovým zářením, které odnáší excitační energii atomu.
Namísto vyzáření rentgenového fotonu může dojít také k vyzáření elektronu. K tomu dochází tak, že elektron z vnějších vrstev elektronového obalu se přesune do nezaplněné vnitřní slupky, přičemž energie není uvolněna ve formě elektromagnetického záření, ale je předána jako kinetická energie některému vnějšímu elektronu, který tím získá dostatek energie, aby atom opustil, což také provede. Excitační energie atomu je tak odnesena vyraženým elektronem. Tento jev, který můžeme považovat za určitou obdobu fotoelektrického jevu, se označuje jako Augerův jev. Při Augerově jevu však nedochází ke vzniku fotonu.
Odkazy
Reference
V tomto článku byly použity překlady textů z článků Emissionsspektrum na německé Wikipedii a Emission spectrum na anglické Wikipedii.
Související články
Média použitá na této stránce
(c) JabberWok, CC BY-SA 3.0
A vector graphic similar of an image originally created by User:PAR, of the Bohr model.
Absorption lines
Autor: Kurzon, Licence: CC BY-SA 3.0
A simple illustration of Bohr's model of the atom, with an electron making quantum leaps.
Autor: Merikanto, Adrignola, Licence: CC0
Visible lines in the hydrogen emission spectrum.
Autor: MikeRun, Licence: CC BY-SA 4.0
simplified Rutherford Bohr model of the hydrogen atom with emissions of photons by electrons jumps between various quantum levels.
Autor:
- File:Atomic orbital energy levels.svg: Richard Parsons (raster), Adrignola (vector)
- derivative work: MikeRun
These are atomic energy levels with their sub-levels. Notice that the s orbital from the next higher energy level has slightly lower energy than the d orbitals in the lower energy level.