Autoionizace vody
Autoionizace vody (nebo autoprotolýza) je chemická reakce, během níž se dvě molekuly vody přemění na hydroxoniový kation H3O+ a hydroxidový anion OH−:
- 2 H2O (l) ⇌ H3O+ (aq) + OH− (aq)
Voda, i ve velmi čistém stavu, není tvořena pouze souborem molekul H2O. Velmi citlivým přístrojem lze i v čisté vodě naměřit slabou konduktivitu 0,055 µS·cm−1. Podle Arrheniovy teorie to musí být způsobeno přítomností iontů.
Koncentrace a frekvence
Rovnovážná konstanta této reakce je:
Z toho plyne, že konstanta kyselosti je: [1]
Pro reakce ve vodě (nebo zředěných vodných roztocích) je molární koncentrace vody, [H2O], prakticky konstantní a konvenčně se odstraňuje ze vztahu pro konstantu kyselosti vody. Tím získáme rovnovážnou konstantu, která se nazývá konstanta autoprotolýzy vody nebo iontový součin vody a je označena Kw:
- Kw = Ka [H2O] = Keq[H2O]2 = [H3O+][OH−],
kde
- [H3O+] – molární koncentrace hydroxoniových iontů
- [OH−] – molární koncentrace hydroxidových iontů
Za standardních podmínek je Kw = 10−14 Čistá voda poskytuje ekvimolární množství ([H3O+]=[OH−]) obou iontů, tzn. že koncentrace jednotlivých iontů je 10−7: náhodně vybraná molekula bude disociovat během 10 hodin.[2] Protože koncentrace vody je disociací prakticky neovlivněná a je rovna přibližně 56 mol·dm−3, můžeme odvodit, že na každých 5,6×108 molekul vody připadá jeden pár iontů. Každý roztok, který obsahuje stejnou koncentraci obou iontů se označuje jako neutrální. Absolutně čistá voda je neutrální, ale i stopy nečistot mohou posunout rovnováhu mezi ionty. Hodnota Kw je citlivá jak k teplotě, tak i k tlaku a zvyšuje se s nárůstem obou veličin.
Závislost na teplotě a tlaku

Podle definice je
- pKw = −log Kw
a za standardních podmínek je
- pKw = −log (1,0×10−14) = 14,0
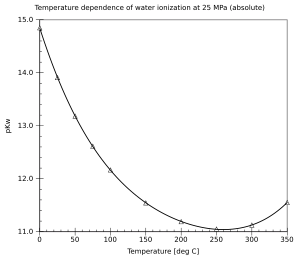
Hodnota pKw je teplotně závislá, s narůstající teplotou její hodnota klesá. To znamená, že ionizace vody narůstá se zvyšující se teplotou.
Existuje také tlaková závislost, ionizace vody vzrůstá společně s tlakem, efekt je ale menší než u teploty. Vliv teploty a tlaku na ionizaci vody byl podrobně zkoumán.[3]
pH
pH je logaritmická stupnice pro kyselost. Je definováno vztahem:
- pH = −log [H3O+]
Protože platí [H3O+] = [OH−], je v neutrálních roztocích za standardních podmínek pH = 7.
Autoionizace vody je proces, který určuje pH vody. Za standardních podmínek je koncentrace hydroxoniových iontů přibližně 1,0×10−7, takže pH čisté vody při této teplotě je sedm. Hodnota Kw narůstá s teplotou, takže v horké vodě bude koncentrace hydroxoniových iontů vyšší než ve studené, ale to neznamená, že se zvyšuje i kyselost vody. Koncentrace hydroxidových iontů se totiž zvyšuje stejným způsobem.
Mechanismus
Geissler a kolektiv zjistil, že fluktuace elektrického pole v kapalné vodě způsobují disociaci molekul.[4] Předpokládali následující posloupnost událostí, které se odehrají přibližně během 150 fs:
- Systém je v neutrálním stavu.
- Náhodná fluktuace v molekulárním pohybu občas (přibližně jednou za deset hodin na každou molekulu vody) vytvoří elektrické pole, které je dostatečně silné na rozbití vazby mezi kyslíkem a vodíkem, čímž vznikne hydroxidový anion (OH−) a hydroxoniový kation (H3O+).
- Proton z hydroxoniového kationtu putuje přes molekuly vody Grotthussovým mechanismem.
- Vytvoří síť vodíkových vazeb v rozpouštědle, která stabilizuje oba ionty solvatací.
Následná reorganizace sítě vodíkových vazeb umožňuje velmi rychlý (1 ps) transfer protonu k nižšímu elektrickému potenciálu a rekombinaci iontů. Tato časová škála odpovídá času, který potřebují vodíkové vazby ve vodě ke změně orientace.[5][6][7]
Izotopové efekty
Těžká voda, D2O, je autoionizovaná méně, než obyčejná voda (H2O). Kyslík vytváří s deuteriem trochu silnější vazbu než s obyčejným vodíkem. Důvodem je jeho vyšší hmotnost, která způsobuje nižší energii nulového bodu. V následující tabulce jsou srovnány hodnoty pKw pro H2O a D2O.[8]
| T (°C) | H2O | D2O |
|---|---|---|
| 10 | 14,5346 | 15,439 |
| 20 | 14,1669 | 15,049 |
| 25 | 13,9965 | 14,869 |
| 30 | 13,8330 | 14,699 |
| 40 | 13,5348 | 14,385 |
| 50 | 13,2617 | 14,103 |
Související články
Reference
V tomto článku byl použit překlad textu z článku Self-ionization of water na anglické Wikipedii.
- ↑ McMurry, John. (2004) Organic Chemistry, pg 44
- ↑ Eigen, M.; de Maeyer, L. Untersuchungen über die Kinetik der Neutralisation I. Z. Elektrochem.. 1955, roč. 59, s. 986.
- ↑ International Association for the Properties of Water and Steam (IAPWS)
- ↑ Geissler, P. L.; Dellago, C.; Chandler, D.; Hutter, J.; Parrinello, M. Autoionization in liquid water. Science. 2001, roč. 291, s. 2121–2124. DOI 10.1126/science.1056991. PMID 11251111.
- ↑ Stillinger, F. H. Theory and Molecular Models for Water. Adv. Chem. Phys.. 1975, roč. 31, s. 1. DOI 10.1002/9780470143834.ch1.
- ↑ Rapaport, D. C. Hydrogen bonds in water. Mol. Phys.. 1983, roč. 50, s. 1151. DOI 10.1080/00268978300102931.
- ↑ Chen, S.-H. & Teixeira, J. Structure and Dynamics of Low-Temperature Water as Studied by Scattering Techniques. Adv. Chem. Phys. 1986, roč. 64, s. 1. DOI 10.1002/9780470142882.ch1.
- ↑ Lide, D. R. (Ed.). CRC Handbook of Chemistry and Physics (70th Edn.). [s.l.]: Boca Raton (FL):CRC Press, 1990.
Literatura
- Klikorka J., Hájek B., Votinský J., Obecná a anorganická chemie, 2. vydání, Praha 1989
Média použitá na této stránce
Autor: Stan J Klimas na projektu Wikipedie v jazyce angličtina, Licence: Attribution
Dependence of water ionization constant on pressure at 25 °C. Based on data from "Release on the Ionization Constant of H2O". International Association for Properties of Water and Steam. August 2007. Image author: Stan J. Klimas. Created using Gnumeric on Linux.
(c) Stan J Klimas na projektu Wikipedie v jazyce angličtina, CC BY 3.0
Temperature dependence of the water ionization constant. Based on data from "Release on the Ionization Constant of H2O". International Association for Properties of Water and Steam. August 2007. Image author: Stan J. Klimas. Created using Gnumeric on Linux.