Imunitní tolerance
Imunitní tolerance je stav neodpovídavosti imunitního systému na určitý antigen nebo antigeny, např. látky a tkáně organismu.[1] Opakem tohoto jevu je imunitní odpověď/reakce, jejímž cílem je eliminace antigenů. Imunitní tolerance je významná pro zachování homeostázy organismu, díky ní imunitní systém rozeznává a nepoškozuje tkáně tělu vlastní, je tzv. autotolerantní. Pokud není imunitní tolerance dostatečně funkční, vznikají autoimunitní choroby.
Tolerance se dělí na centrální a periferní toleranci v závislosti na tom, kde je původně indukována - v brzlíku a kostní dřeni (centrální) nebo v jiných tkáních a lymfatických uzlinách (periferní). Mechanismy, kterými jsou tyto formy tolerance stanoveny, jsou odlišné, ale výsledný účinek je podobný. Centrální tolerance je hlavní způsob, jak se imunitní systém naučí rozlišovat látky tělu vlastní od cizích. Periferní tolerance zásadní pro zabránění nadměrné reaktivitě imunitního systému na různé environmentální entity (alergeny, střevní mikroby atd.). Deficity v centrální nebo periferní toleranci způsobují autoimunitní onemocnění, jako je například systémový lupus erythematodes[2], revmatoidní artritida, diabetes typu 1, autoimunitní polyglandulární syndrom typu 1 (APS-1)[3], imunitní polyendokrinopatie a enteropatie vázaná na X chromosom (IPEX)[4] a pravděpodobně přispívají k astmatu, alergii[5] a zánětlivému onemocnění střev[6] Další významnou roli hraje imunitní tolerance během těhotenství, kdy zajišťuje vývoj semialogenního plodu (s polovinou antigenů od otce) uvnitř mateřského organismu.
Tolerance má však i své stinné stránky. Umožňuje některým patogenním mikrobům úspěšně infikovat hostitele a vyhnout se jeho imunitní odpovědi.[7] Vyvolání periferní tolerance v místním mikroprostředí je také společnou strategií přežití pro řadu nádorů, které se tak brání odstranění hostitelským imunitním systémem.[8]
Historie
Fenomén imunitní tolerance poprvé popsal Ray D. Owens v roce 1945, který si všiml, že dvojčata, která sdílí společnou placentu, sdílí také směs červených krvinek obou jedinců (i když ne nutně 50/50), a to během celého života. Ačkoli Owens nepoužil termín imunitní tolerance, jeho studie ukázala, že tělo může být tolerantní k cizím tkáním. Toto poznání bylo experimentálně ověřeno Rupertem E. Billinghamem a Peterem Medawarem v roce 1953, kteří injekcí cizorodých buněk do myších plodů nebo novorozených myší u nich navodili toleranci, a tyto myši tak později mohly přijímat štěpy od stejného dárce. Přestože původní cíle studie nebyly imunologické, jejich objevy byly klíčové pro vznik teorie imunitní tolerance. Tu formulovali sir Frank Macfarlan Burnet a Frank Fenner, kteří také popsali ustavení tolerance pomocí odstranění autoreaktivních lymfocytů (nyní označované jako klonální delece). V roce 1960 získali Burnet and Medawar Nobelovu cenu za objev získané imunologické tolerance.[1]
Tolerance ve fyziologii a medicíně
Transplantační tolerance
Schopnost imunitního systému rozeznávat cizí antigeny od těch tělu vlastních typicky komplikuje transplantace a vede k odmítnutí štěpu (transplantátu). Existují však dva obecné případy, kdy může být alotransplantát (od jedince téhož druhu, ale s rozdílnou genetickou výbavou) přijat. Jedním je transplantace do imunologicky privilegovaných míst, která jsou do určité míry oddělena od imunitního dohledu (jako oko nebo varlata) anebo mají silné molekulární signály, které zabraňují vzniku nebezpečného zánětu (mozek). Druhým případem je stav tolerance, který byl indukován předchozím vystavením antigenu dárce způsobem, který u příjemce vyvolává imunitní toleranci spíše než senzibilizaci. Dlouhodobé vystavení cizímu antigenu během vývoje plodu nebo krátce po narození může vést ke vzniku centrální tolerance, jak bylo patrné z experimentů Medawara s myšími alotransplantáty.[1] U běžných transplantací takové včasné vystavení antigenu není možné. U některých pacientů se ukázalo, že rozvinuli toleranci alotransplantátu po ukončení veškeré imunosupresivní terapie, což je stav označený jako operační tolerance,[9][10] ovšem standardně většina pacientů užívá imunosupresi doživotně vzhledem k velkým rizikům spojeným s vysazením. Předpokládá se, že hrají roli CD4+ Foxp3+ regulační T buňky, stejně jako CD8+ CD28− regulační T buňky, které tlumí cytotoxické reakce vůči transplantovaným orgánům.[1] Specifická genetická výpava těchto pacientů je může předurčovat ke zvýšené toleranci, byly u nich objeveny např. geny pro funkce NK buněk a γδ T buněk spojené s tolerancí.[9]
Vývoj plodu
Plod má jinou genetickou výbavu než matka, exprimuje také antigeny z genů pocházejících od otce, které jsou maternálním imunitním systémem rozeznávány jako cizorodé. Ženy, které mají více dětí se stejným otcem, mají typicky protilátky proti červeným krvinkám a proteinům MHC otce.[1] Nicméně během fyziologického těhotenství není plod matkou zamítnut, ale naopak je vyživován až do termínu porodu. Placenta, ve které se propojuje maternální i fetální část, brání imunologickému rozeznání snížením produkce MHC proteinů, ale také aktivně indukuje značnou periferní toleranci. Buňky trofoblastu exprimují HLA-G, který zabraňuj útoku mateřských NK buněk, a produkují enzym IDO (indolamin 2,3-dioxygenáza), čímž potlačují odpověď mateřských T buněk na základě snížení množství pro ně kritických aminokyselin. Mateřské T buňky specifické pro otcovské antigeny jsou také potlačeny tolerogenními dendritickými buňkami a indukovanými regulačními T buňkami (iTreg) nebo křížově reagujícími přirozenými regulačnímu T buňkami (nTreg).[11] Některé maternální regulační T buňky také uvolňují rozpustné proteiny (Soluble fibrinogen like protein 2; sFGL2), které potlačují funkci dendritických buněk a makrofágů podílejících se na zánětu a antigenní prezentaci.[11] Tyto mechanismy dohromady vytváří imunoprivilegovaný stav placenty a chrání plod. Narušení této tolerance může mít za následek potrat, předčasný porod, růstové retardace plodu a další patologie těhotenství.[12]
Mikrobiom
Kůže a trávicí trakt lidí a mnoha dalších organismů jsou kolonizovány ekosystémem mikroorganismů, který se nazývá mikrobiom. Ačkoli u savců existuje řada obranných mechanismů, které udržují mikroflóru v bezpečné vzdálenosti, včetně konstantního odběru a prezentace mikrobiálních antigenů místními dendritickými buňkami, většina organismů nereaguje na komensální mikroorganismy a toleruje jejich přítomnost. Reakce se týkají patogenních mikrobů a mikrobů, které poruší fyziologickou bariéru. Imunitní toleranci periferní sliznice zajišťují indukované regulační T buňky (iTreg) a tolerogenní antigen prezentující buňky, konkrétně specializované CD103+ DCs, které produkují jak TGF-β tak i kyselinu retinovou a účinně tak podporují diferenciaci iTreg.[13] Součástí střevní výstelky jsou také Foxp3−TR1 buňky produkující IL-10.[1] Narušení této tolerance je považováno za základ patogeneze zánětlivých onemocnění střev, jako je Crohnova choroba a ulcerózní kolitida.[14]
Nádorové mikroprostředí
Imunitní tolerance je významný prostředek, kterým rostoucí nádory, které exprimují mutované proteiny, zabraňují své eliminaci hostitelským imunitním systémem. Nádory jsou komplexní a dynamickou populací složenou z transformovaných buněk, ale i stromálních buněk, cév, makrofágů a dalších imunitních buněk.[15][16] Tyto buňky a jejich vzájemné interakce přispívají ke vzniku nádorového mikroprostředí, které je značně imunosupresivní a brání odstranění nádoru. Akumulují se zde metabolické enzymy, které potlačují proliferaci a aktivaci T buněk, včetně IDO a arginázy, je zde vysoká exprese toleranci indukujících ligandů, jako jsou FasL, PD-1, CTLA-4 a B7. Farmakologické monoklonální protilátky proti některým z těchto ligandů jsou účinné při léčbě rakoviny.[17] Nádorové vezikuly, exosomy, podporují diferenciaci iTreg buněk a myeloidních supresorových buněk (MDSC), které také indukují periferní toleranci.[8][18]
Vznik
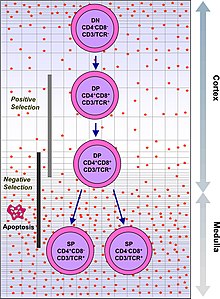
Již v embryonálním stadiu vývoje člověka se vybíjí ty lymfocyty (typ bílých krvinek zodpovědných za tzv. adaptivní imunitu), které reagují na vlastní antigeny (klonální delece). Stále však zbývají určité buňky bez schopnosti imunotolerance. V druhém kole se vyřadí další potenciálně nebezpečné lymfocyty tak, že jim není dodán signál pomocí různých chemických látek (zpravidla cytokinů), následkem čehož takové neaktivované buňky spáchají buněčnou „sebevraždu“. Tento druhý stupeň obrany před autoimunitními chorobami se označuje jako T-buněčná a B-buněčná anergie. Ale i po narození není celý proces u konce a existuje ještě třetí možnost, jak navodit v těle imunotoleranci. Děje se to pomocí určitých cytotoxických nebo regulačních T-lymfocytů, které jsou schopné utlumit nebo zničit zbylé autoreaktivní lymfocyty.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Immune tolerance na anglické Wikipedii.
- ↑ a b c d e f M.), Murphy, Kenneth (Kenneth. Janeway's immunobiology. 8. vyd. New York: Garland Science, 2012. xix, 868 p. s. Dostupné online. ISBN 0815342438. OCLC 733935898
- ↑ CHOI, Jinyoung; KIM, Sang Taek; CRAFT, Joe. The pathogenesis of systemic lupus erythematosus—an update. Current Opinion in Immunology. Roč. 24, čís. 6, s. 651–657. Dostupné online [cit. 2017-09-13]. DOI 10.1016/j.coi.2012.10.004.
- ↑ PERNIOLA, Roberto. Expression of the Autoimmune Regulator Gene and Its Relevance to the Mechanisms of Central and Peripheral Tolerance. Clinical and Developmental Immunology. 2012, roč. 2012, s. 1–12. Dostupné online [cit. 2017-09-13]. ISSN 1740-2522. DOI 10.1155/2012/207403. (anglicky)
- ↑ VERBSKY, James W.; CHATILA, Talal A. Immune dysregulation, polyendocrinopathy, enteropathy, X-linked (IPEX) and IPEX-related disorders. Current Opinion in Pediatrics. Roč. 25, čís. 6, s. 708–714. Dostupné v archivu pořízeném dne 2020-06-13. DOI 10.1097/mop.0000000000000029.
- ↑ MAAZI, H.; LAM, J.; LOMBARDI, V. Role of plasmacytoid dendritic cell subsets in allergic asthma. Allergy. 2013-06-01, roč. 68, čís. 6, s. 695–701. Dostupné online [cit. 2017-09-13]. ISSN 1398-9995. DOI 10.1111/all.12166. (anglicky)
- ↑ ROUND, June L.; O'CONNELL, Ryan M.; MAZMANIAN, Sarkis K. Coordination of tolerogenic immune responses by the commensal microbiota. Journal of Autoimmunity. Roč. 34, čís. 3, s. J220–J225. Dostupné online [cit. 2017-09-13]. DOI 10.1016/j.jaut.2009.11.007.
- ↑ CUROTTO DE LAFAILLE, Maria A.; LAFAILLE, Juan J. Natural and Adaptive Foxp3+ Regulatory T Cells: More of the Same or a Division of Labor?. Immunity. Roč. 30, čís. 5, s. 626–635. Dostupné online [cit. 2017-09-13]. DOI 10.1016/j.immuni.2009.05.002.
- ↑ a b BECKER, Jürgen C.; ANDERSEN, Mads Hald; SCHRAMA, David. Immune-suppressive properties of the tumor microenvironment. Cancer Immunology, Immunotherapy. 2013-07-01, roč. 62, čís. 7, s. 1137–1148. Dostupné online [cit. 2017-09-13]. ISSN 0340-7004. DOI 10.1007/s00262-013-1434-6. (anglicky)
- ↑ a b GÖKMEN, Refik; HERNANDEZ-FUENTES, Maria P. Biomarkers of tolerance. Current Opinion in Organ Transplantation. August 2013, roč. 18, čís. 4, s. 416–420. PMID: 23838646. Dostupné online [cit. 2017-09-15]. ISSN 1531-7013. DOI 10.1097/MOT.0b013e3283636fd5. PMID 23838646.
- ↑ BRAZA, Faouzi; SOULILLOU, Jean-Paul; BROUARD, Sophie. Gene expression signature in transplantation tolerance. Clinica Chimica Acta. Roč. 413, čís. 17–18, s. 1414–1418. Dostupné online [cit. 2017-09-15]. DOI 10.1016/j.cca.2012.04.024.
- ↑ a b CLARK, David A.; CHAOUAT, Gerard. Regulatory T cells and reproduction: how do they do it?. Journal of Reproductive Immunology. Roč. 96, čís. 1–2, s. 1–7. Dostupné online [cit. 2017-09-15]. DOI 10.1016/j.jri.2012.07.007.
- ↑ CHRISTIANSEN, Ole B. Reproductive immunology. Molecular Immunology. Roč. 55, čís. 1, s. 8–15. Dostupné online [cit. 2017-09-15]. DOI 10.1016/j.molimm.2012.08.025.
- ↑ CUROTTO DE LAFAILLE, Maria A.; LAFAILLE, Juan J. Natural and Adaptive Foxp3+ Regulatory T Cells: More of the Same or a Division of Labor?. Immunity. Roč. 30, čís. 5, s. 626–635. Dostupné online [cit. 2017-09-15]. DOI 10.1016/j.immuni.2009.05.002.
- ↑ ROUND, June L.; O'CONNELL, Ryan M.; MAZMANIAN, Sarkis K. Coordination of tolerogenic immune responses by the commensal microbiota. Journal of Autoimmunity. Roč. 34, čís. 3, s. J220–J225. Dostupné online [cit. 2017-09-15]. DOI 10.1016/j.jaut.2009.11.007.
- ↑ BECKER, Jürgen C.; ANDERSEN, Mads Hald; SCHRAMA, David. Immune-suppressive properties of the tumor microenvironment. Cancer Immunology, Immunotherapy. 2013-07-01, roč. 62, čís. 7, s. 1137–1148. Dostupné online [cit. 2017-09-15]. ISSN 0340-7004. DOI 10.1007/s00262-013-1434-6. (anglicky)
- ↑ AKTIPIS, C. Athena; BODDY, Amy M.; GATENBY, Robert A. Life history trade-offs in cancer evolution. Nature Reviews Cancer. Roč. 13, čís. 12, s. 883–892. Dostupné online. DOI 10.1038/nrc3606.
- ↑ RAMSAY, Alan G. Immune checkpoint blockade immunotherapy to activate anti-tumour T-cell immunity. British Journal of Haematology. 2013-08-01, roč. 162, čís. 3, s. 313–325. Dostupné online [cit. 2017-09-15]. ISSN 1365-2141. DOI 10.1111/bjh.12380. (anglicky)
- ↑ LINDAU, Dennis; GIELEN, Paul; KROESEN, Michiel. The immunosuppressive tumour network: myeloid-derived suppressor cells, regulatory T cells and natural killer T cells. Immunology. 2013-02-01, roč. 138, čís. 2, s. 105–115. Dostupné online [cit. 2017-09-15]. ISSN 1365-2567. DOI 10.1111/imm.12036. (anglicky)
Literatura
- FERENČÍK, M; ROVENSKÝ, J; SHOENFELD, Y; MAŤHA, V. Imunitní systém; informace pro každého. 1. české. vyd. Praha: Grada Publishing, 2005.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Imunitní tolerance na Wikimedia Commons
Obrázky, zvuky či videa k tématu Imunitní tolerance na Wikimedia Commons - Radkin Honzák O mikrobiomu, DVTV 22.7.2019[1]
Média použitá na této stránce
Autor: Wilson Savino is at the Laboratory on Thymus Research, Department of Immunology, Oswaldo Cruz Institute, Inserm-Fiocruz Associated Laboratory of Immunology, Oswaldo Cruz Foundation, Rio de Janeiro, RJ, Brazil. E-mail: savino@fiocruz.br, Licence: CC BY 2.5
The Normal Process of Intrathymic T Cell Differentiation
