Aza-Copeův přesmyk
Aza-Copeův přesmyk je organická reakce, která má velké využití v organické syntéze, protože ji lze využít k rychlé tvorbě složitějších struktur ze strukturně jednodušších výchozích látek. Aza-Copeovy přesmyky patří mezi heteroatomární varianty Copeova přesmyku, což je [3,3]-sigmatropní přesmyk, při němž se posouvají jednoduché a dvojné vazby mezi dvěma allylovými reaktanty. Podle Woodwardových–Hoffmannových pravidel probíhají tepelné aza-Copeovy přesmyky suprafaciálně.[1] Aza-Copeovy přesmyky se klasifikují podle polohy dusíku v molekule:
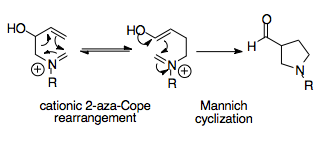
Prvním popsaným případem aza-Copeova přesmyku byl kationtový 2-aza-Copeův přesmyk, probíhající za teploty o 100 až 200 °C nižší než Copeův přesmyk.[2] Na snadném provedení reakce má podíl termoneutralita reakce a přítomnost kladně nabitého dusíku v molekule, která snižuje její aktivační energii. K méně častým reakcím patří 1-aza- a 3-aza-Copeovy přesmyky, které mají vyšší aktivační energie a omezenější syntetické využití.[3][4][5] Za účelem vylepšení využitelnosti se kationtové 2-aza-Copeovy přesmyky obvykle spojují s dalšími reakcemi, jako je Mannichova cyklizace. Tato spojená reakce probíhá za mírných podmínek, vyznačuje se diastereoselektivitou, a má velké syntetické využití. Lze pomocí ní snadno připravit acylované pyrrolidiny, což je struktura nacházející se v řadě přírodních látek, jako jsou například alkaloidy, a používá se například při přípravě strychninu a krininu.[6] Aza-Copeovými přesmyky se podrobně zabýval Larry E. Overman.[1]
Kationtový 2-aza-Copeův přesmyk
Kationtový 2-aza-Copeův přesmyk, přesněji nazývaný jako 2-azonia-[3,3]-sigmatropní přesmyk, studoval Larry E. Overman. Jedná se o nejlépe prozkoumaný druh aza-Copeova přesmyku, protože probíhá za mírných podmínek a má také široké syntetické využití, například při syntéze alkaloidů. Při 2-aza-Copeových přesmycích nevznikají vedlejší produkty, jelikož štěpení a tvorba vazeb v obou směrech jsou ekvivalentní, podobně jako u Copeova přesmyku. Přítomnost nabitého atomu dusíku způsobuje, že je reakce oproti klasickému Copeovu přesmyku rychlejší.
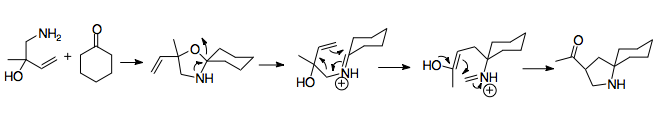
První 2-aza-Copeův přesmyk byl popsán v roce 1950, a to při neúspěšném pokusu o přípravu aminoalkoholu.[2] This discovery identified the basicByl určen základní mechanismus přesmyku podle toho, že produkt se pravděpodobně vytvořil při dusíkatém ekvivalentu Copeova přesmyku. Reakcí allylbenzylaminu (A) s kyselinou mravenčí a formaldehydem vznikl aminoalkohol (B). Aminoalkohol se adicí kyseliny přeměnil na imin (C), u kterého proběhl kationtový 2-aza-Copeův přesmyk (D). Hydrolýzou iminiového iontu vznikl amin (E). Při reakci výchozí látky se samotným formaldehydem po přesmyku docházelo k alkylaci aminové skupiny.[2]
Jelikož reakce, na rozdíl od čistě uhlovodíkového Copeova přesmyku, probíhá za mírných podmínek, tak se předpokládá, že kladný náboj na dusíku výrazně snižuje aktivační energii přesmyku.[2]
Mechanismus
Urychlení reakce kladně nabitým dusíkem
Aza-Copeovy přesmyky podle Woodwardových–Hoffmannových pravidel probíhají suprafaciálně. Toto nebylo ověřeno a takový průběh se pouze předpokládá na základě skutečnosti, že při zásaditě katalyzovaném oxy-Copeově přesmyku nabitý atom narušuje sigmatropní přesmyk a mění mechanismus ze soustředěného (který by se u Copeova přesmyku dal očekávat) na částečně diradikálový/dipolární, což je způsobeno delokalizací kladného náboje na allylovém zbytku, což vede k oslabení allylové vazby a snížení aktivační energie štěpení vazby. Kationtové aza-Copeovy přesmyky tak probíhají rychleji než klasické Copeovy přesmyky.[6][7]
Meziprodukt a stereochemie
Kationtové 2-aza-Copeovy přesmyky se vyznačují vysokou stereospecificitou, která je důsledkem toho, že u meziproduktu výrazně převažuje židličková konformace nad ostatními. L. E. Overman se svými spolupracovníky podrobně prozkoumali tuto vlastnost podobnými postupy, jako u Doeringova a Rothova experimentu,[8] který ukázal na převahu židličkové konformace.[9] S využitím kationtového 2-aza-Copeovy/Mannichovy reakce pyrrolizidinů zjistili, že většinově vznikají produkty s cis substituenty u E-alkenových a s trans substituenty u Z-alkenových reaktantů, což naznačuje tvorbu meziproduktu v židličkové konformaci. Kdyby vznikal přechodný stav s lodičkovou konformací, tak by reakce probíhala opačně.[9] Podobně jako u mnoha jiných reakcí má přeměna Z-enolátů kvůli 1,3-diaxiálním sterickým interakcím mezi enolátem a cyklem nižší selektivitu. Tímto lze vysvětlit potřebu vyšších teplot při reakcích Z-enolátů.[6][9] U kationtových 2-aza-Copeových přesmyků je přechodný stav v lodičkové konformaci ještě méně pravděpodobný než u klasických Copeových přesmyků: podobně v případech, kdy Copeovy přesmyky mají lodičkové přechodné stavy, tak meziprodukty aza-Copeových přesmyků stále mají židličkovou geometrii.[1][6][10] Tyto výsledky odpovídají údajům získaným pomocí výpočetních metod.[11]
Výsledky těchto experimentů také naznačují, že kationtové 2-aza Copeovy přesmyky (stejně jako Mannichovy cyklizace) probíhají rychleji než enolové či iminiové tautomerizace. Pokud by to mu tak nebylo, tak by se neobjevovala žádná stereospecifita.[1]
Další faktory ovlivňující stereochemii
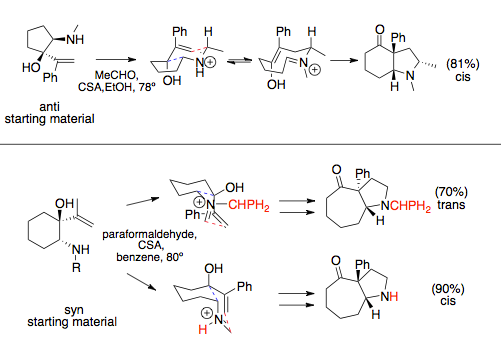
Na stereochemii aza-Copeových/Mannichových reakcí použitých v anulačních reakcích má vliv meziprodukt s židličkovou konformací, který způsobuje, že objemné substituenty se obvykle navážou kvaziekvatoriálně. Vinylové a aminové skupiny mohou reakci řídit podle toho, zda jsou v konfiguraci syn- nebo anti. Velký vliv mívají aminové skupiny, u kterých velké substituenty vedou k tvorbě syn-produktů. U reaktantů s anti vinylovými a aminovými substituenty vzniká jediný přechodný stav, vedoucí ke vzniku cis cyklických sloučenin, zatímco v případě syn substituentů mohou vznikat různé meziprodukty v závislosti na sterických interakcích s rozpouštědlem nebo velkými dusíkatými substituenty, u nichž může dojít ke změnám konfigurace přechodného stavu.[12][13]
U jednoduchých aza-Copeových/Mannichových reakcí nezařazených do anulací, jako jsou kondenzace aminoalkoholů s ethery, probíhají rotace vazeb rychleji než Mannichovy cyklizace a tvoří se racemáty.[14] Tomu se lze vyhnout použitím chirálních pomocníků v podobě substituentů na aminových skupinách. U takto upravených reaktantů k rotacím vazeb nedochází.[1]
Aza-Copeova/Mannichova reakce
Aza-Copeova/Mannichova reakce je synteticky dobře využitelná reakce, pomocí které lze získat složité cyklické molekuly z jednoduchých výchozích látek. Umožňuje termodynamické řízení ve prospěch konkrétního produktu, protože Mannichova cyklizace je nevratná a její produkt, acylovaný pyrrolidin, vykazuje větší stabilitu než produkt přesmyku.[1][15]
První aza-Copeova/Mannichova reakce
L. E. Overman se svými spolupracovníky zjistil, že kationtové 2-aza-Copeovy přesmyky by mohly být synteticky využitelné, pokud by bylo možné využít vhodný způsob termodynamického řízení. Tato myšlenka byla využita k zapojení nukleofilních substituentů, konkrétně alkoholových skupin, do výchozích látek, které se po provedení přesmyku přemění na enoly, čímž umožní atak iminiového iontu.
První popsanou variantou byla reakce aldehydehydů s 2-alkoxy-3-butenaminy, kterou vznikaly aminoalkoholy, jejichž aza-Copeovy/Mannichovy produkty byly acylované pyrrolidiny. Tento postup vyžadoval mírné zahřívání po dobu několika hodin. Ukázalo se, že aza-Copeovy/Mannichovy reakce se vyznačují velmi dobrými výtěžnostmi. Lze je lehce využít ke kondenzačním reakcím aminoetherů, při kterých se nejprve methyluje alkohol.[15] Po aza-Copeově/Mannichově reakci se adicí za přítomnosti hydroxidu sodného vytvoří keton.[15] Amin zde nemůže způsobit tvorbu iminiových iontů ze zásaditých ketonů; metody zapojující do reakce ketony byly vyvinuty později.[15][16] Výhodnost této reakce mimo jiné dokazuje to, že reakce probíhá, i když se vytvoří méně stabilní izomer, z čehož vyplývá termodynamická výhodnost reakce.[12][16]
Mechanismus
Hlavní produkt reakce může vznikat dvěma různými způsoby: aza-Copeovou/Mannichovou reakcí a aza-Prinsovou cyklizací s pinakolovým přesmykem. Tyto mechanismy mají rozdílné stereochemické vlastnosti, čímž lze vysvětlit převahu aza-Copeova/Mannichova mechanismu. Při aza-Copeově/Mannichově reakci každý atom v analogu [1,5] dienu podléhá sp2 hybridizaci, čímž naruší stereochemii reaktantu na pozici R', zatímco u aza-Prinsovy reakce s pinakolovým přesmykem zůstává stereochemie na tomto místě zachována; díky tomu je možné pomocí jednoduchého testu zjistit, který mechanismus převažuje. U enantiomerně čistého výchozího materiálu v pozici "R'" bude vznikat racemická směs, pokud je převažujícím mechanismem aza-Copeova/Mannichova reakce, zatímco při převaze aza-Prinsovy cyklizace s pinakolovým přesmykem by stereochemie měla být zachována. Zda je produkt racemický, lze ověřit jednoduše, díky čemuž se dá ověřit, že převažujícím mechanismem je aza-Copeova/Mannichova reakce. Tato skutečnost byla ověřena tím, že účinnost tvorby karbeniového iontu při aza-Prinsově/pinakolovém mechanismu by bylo možné zvýšit stabilizací kladného náboje vhodným substituentem, který by pozměnil reaktivitu při tomto průběhu. Bylo vyzkoušeno několik různých substituentů a zjistilo se, že jejich vliv na výsledek reakce je malý, což také ukazuje na převahu aza-Copeova/Mannichova mechanismu.[14] Aza-Prinsův/pinakolový mechanismus se projevuje pouze při výrazně navýšené nukleofilitě alkenu a elektrofilitě iminu.[1][6][17]
Aza-Copeova/Mannichova reakce má vysokou diastereoselektivitu, což je v souladu s výsledky stereochemických experimentů, při kterých byly určeny vlastnosti meziproduktu kationitového 2-aza-Copeova přesmyku. Stereochemie této reakce je poněkud složitější, pokud jsou na cykly v reaktantech navázány allylové a aminové substituenty, kdy se projevuje i cis-trans izomerie.
Využití 2-aza-Copeovy/Mannichovy reakce
Aza-Copeovy/Mannichovy reakce jsou často nejefektivnějšími způsoby syntézy pyrrolidinů a využívají se tak při přípravě mnoha přírodních látek. Díky její diastereoselektivitě lze tuto reakci použít k asymetrické syntéze, například při přípravě alkaloidů. Může být použita k tvorbě dalších cyklických struktur využitelných v syntézách, například indolizidinů a indolů.[1]
Totální syntéza (−)-strychninu
Praktické využití 2-aza-Copeovy/Mannichovy reakce lze ukázat na příkladu Overmanovy totální syntézy strychninu, což je alkaloid nacházející se v rostlinách z rodu kulčiba (Strychnos). Strychnin je často používanou látkou hubící malé obratlovce. První totální syntézu strychninu popsal R. B. Woodward,[18] přičemž do té doby se nepodařilo uměle vytvořit sloučeninu s takto složitou strukturou. Další totální syntézy byly popsány koncem 80. let 20. století; při nich byly používány podobné postupy, jako jsou využití meziproduktů, které také vznikají rozkladem strychninu. Všechny tyto syntézy probíhaly za tvrdých podmínek. Overman tyto potíže překonal a vyvinul i první asymetrickou totální syntézu strychninu, čímž dosáhl diastereoselektivity a mírných reakčních podmínek, při jakých se provádí aza-Copeova/Mannichova reakce. Krok zahrnující aza-Copeovu/Mannichovu reakci měl téměř stoprocentní výtěžnost. Overmanova syntéza je o několik řádů účinnější než předchozí postupy.[18]
Overmanovu syntézu strychninu lze považovat za dobrý příklad přípravy prekurzorů potřebných pro aza-Copeovu/Mannichovu reakci, protože se jedná o účinné využití otevírání epoxidového kruhu. Hlavní kroky syntézy substrátu zahrnují Stilleovu reakci, při níž se spojí dva prekurzory, epoxidaci dvojné vazby terc-butylhydroperoxidem, Wittigovu reakci sloužící k přeměně ketonu na alken, a cyklizaci. Následně se provede alkylace aminu (není znázorněna), čímž se vytváří substrát pro přesmyk. Tento postup se vyznačuje enantioselektivitou podobnou jako u aza-Copeovy/Mannichovy reakce, protože je konfigurace konečného produktu určena konfigurací výchozí látky: který enantiomer strychninu se vytvoří, je určeno enantiomerem výchozího materiálu.[18][19]
Syntéza (−)-krininu
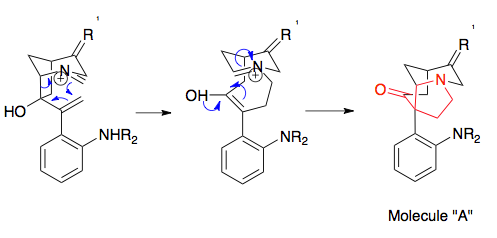
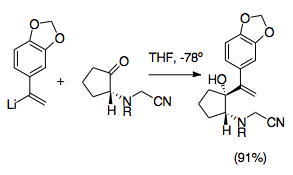
Krinin je alkaloid vyskytující se u rostlin z čeledi amarylkovitých a jedna z prvních látek připravená pomocí asymetrické totální syntézy s využitím aza-Copeovy/Mannichovy reakce. Jednalo se o významný pokrok ve výzkumu aza-Copeových/Mannichových reakcí, jelikož patří mezi jejich nejvyužívanější varianty. Využívá vlastnosti kationtových-2-aza-Copeových přesmyků v podobě vysoké diastereoselektivity a také se při ní používají kyanomethylové chránicí skupiny, které chrání aminové skupiny v průběhu adice vinyllithia; jako odstupující skupina rovněž vyvolávají vznik iminiových iontů, asistovaný adicí dusičnanu stříbrného.[20]
Tato syntéza je jednou z mnoha syntetických metod, které využívají kyanomethylové skupiny k přípravě pyrrolidinů a indolizidinů.
Příprava tricyklických alkaloidů
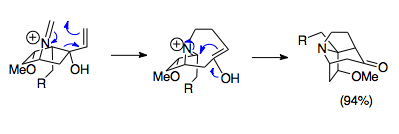
Overman se svými spolupracovníky vyvinul řadu postupů syntézy složitých tricyklických struktur pomocí aza-Copeových/Mannichových reakcí. Tyto aza-tricyklické struktury jsou součástmi alkaloidů vyskytujících se u rostlin rodu Stemona a mohou mít uplatnění při výrobě některých léčiv, například imunosupresiv. Na následujícím obrázku je jako příklad znázorněna reakce 1-aza-bicyklo[2.2.1]heptanové soli s paraformaldehydem při 80 °C vedoucí ke vzniku pivotalové aza-tricyklické skupiny. I přes nevýhodnost překryvu orbitalů v důsledku sterických efektů se dosahuje výtěžnosti o hodnotě 94 %.[21]
Otevírání a rozšiřování cyklů
Aza-Copeovy/Mannichovy reakce, kterých se účastní molekuly již obsahující cykly, lze použít k přípravě indolizidinových (s pyrolidinem spojeným s cyklohexanovým kruhem) sloučenin. Při těchto reakcích se otevírají cyklopentanové kruhy pomocí přesmyků a uzavírají se Mannichovou cyklizací za vzniku šestičlenných cyklů navázaných na pyrrolidinovou skupinu. Takto je možné získat i sedmičlenné cykly, protože enoly a iminiové ionty se nacházejí v dostatečné blízkosti, aby u nich mohla proběhnout Mannichova cyklizaci.[20] Příprava makrocyklů tímto způsobem nebyla popsána, protože enol a iminium se nenacházejí dostatečně blízko u sebe.[6]
Jako substráty přesmyku lze použít i vinyloxazolidiny. Nejprve se tvoří vinyloxazolidin atakem aminobutenolu na cyklohexanon a následně dojde při zahřívání za přítomnosti kyseliny (Lewisovy nebo protické) aza-Copeova/Mannichova reakce. Poté proběhne rozpad cyklu a tvorba pětičlenného kruhu. Další možností je navázání oxazolidinu na další kruh.[22]
Srovnání s jinými metodami
Aza-Copeovy/Mannichovy reakce mají řadu výhod ve srovnání s jinými metodami; patří k nim nízká reakční teplota (obvykle do 80 °C), velké množství použitelných rozpouštědel a přídavek 1 ekvivalentu kyseliny, kterou je obvykle kyselina kamforsulfonová nebo některá Lewisova kyselina. Ostatní způsoby přípravy pyrrolidinů nemají takovou stereospecificitu, široké využití, ani spektrum použitelných výchozích látek. Reakce má vysokou diastereoselektivitu a probíhá i v případech, kdy je v přechodném stavu nevýhodný překryv orbitalů.[1]
Tyto vlastnosti aza-Copeovy/Mannichovy reakce vedly k hledání způsobů přípravy vhodných výchozích látek; tyto metody se dělí do dvou hlavních oblastí: adice aminů s tvorbou iminiových iontů (znázorněna červeně) a navazování vinylových substituentů (znázorněno modře). Při reakci může být použito mnoho různých N-substituentů (R), alkylových i arylových, přičemž některé ovlivňují stereochemii produktů. Z vinylových skupin jsou obvykle vhodné jen ty, které jsou 1,1- nebo 1,2-disubstituované.[1]
Adice aminů s tvorbou iminiových iontů
Otevírání epoxidových kruhů
Díky úhlovému napětí lze na molekuly epoxidů snadno navázat aminové skupiny dva atomy od alkoholových skupin. Epoxidový kruh je nejdříve otevřen nukleofilním atakem bromidu; jako nukleofily mohou rovněž sloužit primární nebo aromatické aminy či lithné anilidy. Po tomto kroku se často provádí O-methylace, čímž se naváže chránicí skupina.
Pokud sterické efekty umožní atak pouze na jednom konkrétním uhlíku, tak nastane přímý vnitromolekulární atak na dusík; taková reakce probíhá například při syntéze strychninu.[15][23]
Tvorba iminiových iontů
Nejčastějším způsobem tvorby iminiových iontů při napojování aminových skupin je adice formaldehydu nebo paraformaldehydu, kde se iminium tvoří kysele katalyzovanou kondenzací. Tento postup je mimo jiné součástí Overmanovy syntézy strychninu.[6][23] Občas se využívají též vnitromolekulární reakce s karbonylovými skupinami.[9] Dalšími možnostmi jsou využití kyanomethylových skupin a nebo oxazolidinových prekurzorů karbonylů.
Alkylace aminů
Alkylace aminů je častou metodou přípravy prekurzorů iminů. Alkylace přímými SN2 reakcemi se provádí jen ojediněle, protože u aminů často dochází k přealkylování, tedy navázání vyššího počtu alkylů, než jaký je potřeba.[23] Častější je reduktivní aminace, která byla použita i u prvního aza-Copeova přesmyku.[15][24][25]
Nejčastějším způsobem alkylace aminů je tvorba amidové vazby a její následná redukce, obvykle pomocí hydridu lithno-hlinitého.[9]
Použití oxazolidinů
Ketony a stericky ovlivněné aldehydy nelze zapojit do zásaditě katalyzovaných aza-Copeových/Mannichových reakcí, protože aminy s nimi nemohou vytvářet iminiové ionty. Náhradou je dehydratační tvorba oxazolidinů nanásledovaná zahříváním za přítomnosti stechiometrického množství kyseliny.
Využití oxizolidinů k získání iminiových iontů popsal L. E. Overman; zjistil, že při přípravě pyrrolidinů lze jako karbonylové reaktanty použít deriváty cyklohexanonu.[16] Je možné použít mnoho různých cyklohexanonů. Při použití substituovaných acyklických ketonů má reakce kvůli termodynamické výhodnosti odštěpení cyklohexanonu, způsobené úhlovým napětím v židličkové konformaci, nízkou výtěžnost.
Pomocí oxazolidinů se například vytváří 1-azaspiro[4,5]dekanové cykly, používané při přípravách přírodních látek.[16]
Navázání vinylové skupiny
Vinylace ketonů
Vinylací lze získat další syntetické možnosti, a tím rozšířit využitelnost reakce.[21] Obvykle se k tomuto účelu používají organolithné sloučeniny. Často se také na dusík připojuje substituent nebo chránicí skupina, i když to není vždy nutné. Přidání lithia do reakce má výrazný vliv na stereochemii výchozího materiálu, protože se na něj koordinuje dusík. Z takto upravených výchozích materiálů obvykle vznikají anti aza-Copeovy prekurzory, zatímco z ostatních, například těch, které obsahují vysoce substituované a stericky ovlivněné aminy, se tvoří syn prekurzory. Tyto vlivy dusíkatých substituentů mají velký význam.[6][23]
Využití kyanomethylových skupin
Kyanomethylové skupiny jsou snadným způsobem ochrany iminiových iontů během allylové vinylace ketonů. Kyanamidové skupiny a jejich analogy se při přípravě iminiových iontů využívají často. Obvykle se navazují prostřednictvím nukleofilních adicí na iminium, nejčastěji alkylací aminu formaldehydem. Iminiový ion je tak stíněn.[26] Použití kyanomethylových skupin umožňuje snadné řízení aza-Copeovy/Mannichovy reakce. Kyanomethyl chrání dusík v pozici 2 v průběhu tvorby dalších allylových analogů. Následně představuje dobrou odstupující skupinu při vzniku iminiového iontu.[27]
Vznik iminiových iontů z kyanomethylových skupin se obvykle spouští přídavkem dusičnanu stříbrného, lze však také použít i jiné sloučeniny stříbra a nebo mědi. Tímto způsobem lze řídit tvorbu iminiových iontů s ještě větší přesností.[6][27] Uvedené reakce se musí provádět za teplot okolo −78 °C, aby nedocházelo ke vzájemnému působení mezi kyanomethyly a vinyllithiem. Tato metoda umožňuje využití mnoha různých dusíkatých substituentů a může být použita ke zjednodušení syntézy oktahydroindolů a pyrrolů.[1][27]
1- a 3-aza-Copeovy přesmyky
1- a 3-aza-Copeovy přesmyky jsou ve srovnání s kationtovými 2-aza-Copeovými přesmyky vzácnější, jelikož mají mnohem vyšší aktivační energie.
1- a 3-aza-Copeovy přesmyky vedou ke vzniku iminů častěji než k enaminům, protože vazby π mezi uhlíkem a dusíkem jsou silnější než příslušné vazby σ, takže je termodynamicky výhodnější 3-aza-přesmyk oproti 1-aza-přesmyku: imin má energii o asi 40 kJ/mol nižší. Vysoké aktivační energie těchto reakcí jsou tak kinetického původu.[28] Výzkumy 1- i 3-aza-Copeových přesmyků byly zaměřené na hledání způsobů snížení těchto aktivačních energií. Pro možné syntetické využití bylo vyvinuto několik variant takovýchto přesmyků. 1-aza-Copeovy přesmyky se obvykle propojují s termodynamickými metodami a 3-aza-Copeovy přesmyky se většinou provádějí kationtově.[28][29]
Jak 1-, tak i 3-aza-Copeovy přesmyky probíhají převážně přes meziprodukty s židličkovými konformacemi (a zachovává se při nich stereochemie, podobně jako u kationtových 2-aza-Copeových přesmyků), lze je urychlit pomocí zavedení kladných nábojů, což dodává meziproduktům více diradikálové a dipolární vlastnosti.[29] 3-aza-Copeovy přesmyky (a tedy i 1-aza-přesmyky, které probíhají přes stejné přechodné stavy) by tak měly mít méně aromatické přechodné stavy než obecné Copeovy přesmyky a kationtové 2-aza-Copeovy přesmyky, což vede k vyšším reakčním teplotám (blízkým teplotám využívaným u Copeových přesmyků i vyšších, mezi 170 a 300 °C) potřebným k překonání kinetických aktivačních bariér.[3][29][30]
3-aza-Copeovy přesmyky
3-aza-Copeův přesmyk byl objeven krátce po 2-aza-Copeově přesmyku, protože má podobný vztah ke Claisenově přwsmyku; nejprve byl popisován jako amino-Claisenův přesmyk, což je nepřesné označení, protože molekuly, které se do něj zapojují, obsahují atomy dusíku i kyslíku.[3] Tento přesmyk se používá na přípravu heterocyklů obsahujících uhlík, nejčastěji piperidinů.
Jeden z prvních případů popsal Robert Burpitt, který si všiml přesmyku probíhajícího u kvartérních amoniových solí, kde v důsledku působení elektrického náboje, probíhal exotermicky, aniž by bylo nutné zahřívání; bez přítomnosti tetrasubstituovaného dusíku by k reakci nedošlo.[31] Na základě tohoto objevu byl výzkum 3-aza-Copeovýcgh přesmyků zaměřen převážně na zwitteriontové varianty reakce, protože rozprostření elektrického náboje snižuje aktivační energii: v některých případech lze reakci provést i při teplotách okolo −20 °C.[28][32]
První 3-aza-Copeův přesmyk nenabitých molekul byl proveden v roce 1967. Po vytvoření dostatečně substituovaných enaminů a následném zahřívání proběhl téměř úplný přesmyk na iminy; tato reakce má však jen omezené možnosti využití.[33]
1-aza-Cope rearrangement
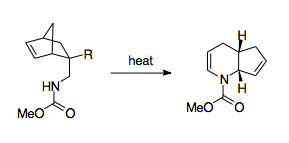
První popsaný 1-aza-Copeův přesmyk byl analogem obecného Copeova přesmyku a k jeho provedení bylo třeba zahřívání na vysoké teploty, aby byla překonána vysoká termodynamická aktivační bariéra; většina dalšího výzkumu ohledně 1-aza-Copeových přesmyků tak byla soustředěna na zmírnění reakčních podmínek. V důsledku přítomnosti heteroatomu se v průběhu reakce v kroku určujícím její rychlost pravděpodobně vytváří meziprodukt s částečně diradikálovými a dipolárními vlastnostmi.[4]
F. W. Fowler učinil z 1-aza-Copeových přesmyků postupy prakticky využitelné v organické syntéze.[3] Všiml si, že vysoká energetická bariéra reakce způsobuje, že produkt přetrvává v iminové formě, a tak by mohlo být výhodné dusík stabilizovat. Za tímto účelem napojil na dusík karbonylovou skupinu, protože volný elektronový pár na dusíku by měl být stabilizován účastí na amidové vazbě, a tak být elektronegativita této skupiny nižší než u LUMO iminové skupiny, což by vedlo k upřednostnění přechodného stavu.[3] Tímto způsobem se podařilo pomocí 1-aza-Copeova přesmyku připravit deriváty piperidinu a pyridinu. Ukázalo se, že lze takto připravovat i ty produkty, u nichž reakce musí probíhat přes lodičkový meziprodukt nebo společně s jinými přesmyky.[3] Důležitá je též poměrně snadná příprava reaktantů, při kterých se používají Dielsovy–Alderovy reakce.[3]
Dalším způsobem překonání termodynamické bariéry je propojení reakce s uvolněním napětí na cyklopropanovém kruhu, které dovoluje výrazně snížit reakční teplotu.[28][34]
Reference
- ↑ a b c d e f g h i j k L. E. Overman; P. G. Humphreys; G. S. Welmaker. Organic Reactions. [s.l.]: [s.n.], 2011. ISBN 978-0471264187. doi:10.1002/0471264180.or075.04. Kapitola The Aza-Cope/Mannich Reaction, s. 747–820.
- ↑ a b c d R. M. Horowitz; T. A. Geissman. A Cleavage Reaction of α-Allylbenzylamines. Journal of the American Chemical Society. 1950, s. 1518–1522. doi:10.1021/ja01160a025.
- ↑ a b c d e f g M. Chu; P. L. Wu; S. Givre; F. W. Fowler. The 1-AZA-Cope rearrangement. Tetrahedron Letters. 1986, s. 461–464. doi:10.1016/S0040-4039(00)85505-7.
- ↑ a b P. L. Wu; F. W. Fowler. The 1-aza-Cope rearrangement. 2. The Journal of Organic Chemistry. 1988, s. 5998–6005. doi:10.1021/jo00261a003.
- ↑ G. R. Cook; N. S. Barta; J. R. Stille. Lewis acid-promoted 3-aza-Cope rearrangement of N-alkyl-N-allyl enamines. The Journal of Organic Chemistry. 1992, s. 461–467. doi:10.1021/jo00028a016.
- ↑ a b c d e f g h i L. E. Overman; L. T. Mendelson; E. J. Jacobsen. Synthesis applications of aza-Cope rearrangements. 12. Applications of cationic aza-Cope rearrangements for alkaloid synthesis. Stereoselective preparation of cis-3a-aryloctahydroindoles and a new short route to Amaryllidaceae alkaloids. Journal of the American Chemical Society. 1983, s. 6629–6637. doi:10.1021/ja00360a014.
- ↑ L. E. Overman. Charge as a key component in reaction design. The invention of cationic cyclization reactions of importance in synthesis. Accounts of Chemical Research. 1992, s. 352–359. doi:10.1021/ar00020a005.
- ↑ W. v. E. Doering; W. R. Roth. The overlap of two allyl radicals or a four-centered transition state in the cope rearrangement. Tetrahedron. 1962, s. 67–74. doi:10.1016/0040-4020(62)80025-8.
- ↑ a b c d e R. J. Doedens; G. P. Meier; L. E. Overman. Synthesis applications of cationic aza-Cope rearrangements. Part 17. Transition-state geometry of [3,3]-sigmatropic rearrangements of iminium ions. The Journal of Organic Chemistry. 1988, s. 685–690. doi:10.1021/jo00238a039.
- ↑ E. Vogel; W. Grimme; E. Dinne. Thermal Equilibrium between cis-1,2-Divinylcyclo-pentane and cis,cis-1,5-Cyclononadiene. Angewandte Chemie International Edition in English. 1963, s. 739–740. doi:10.1002/anie.196307392.
- ↑ M. Lukowski; K. Jacobs; P. Hsueh; H. A. Lindsay; M. C. Milletti. Thermodynamic and kinetic factors in the aza-Cope rearrangement of a series of iminium cations. Tetrahedron. 2009, s. 10311–10316. doi:10.1016/j.tet.2009.10.010.
- ↑ a b S. F. McCann; L. E. Overman. Medium Effects and the Nature of the Rate-Determining Step in Mannich-Type Cyclizations. Journal of the American Chemical Society. 1987, s. 6107–6114. doi:10.1021/ja00254a033.
- ↑ L. E. Overman; W. C. Trenkle. Controlling Stereoselection in Aza-Cope-Mannich Reactions. Isr. J. Chem.. 1997, s. 23–30. doi:10.1002/ijch.199700005.
- ↑ a b E. J. Jacobsen; J. Levin; L. E. Overman. Synthesis applications of cationic aza-Cope rearrangements. Part 18. Scope and mechanism of tandem cationic aza-Cope rearrangement-Mannich cyclization reactions. Journal of the American Chemical Society. 1988, s. 4329–4336. doi:10.1021/ja00221a037.
- ↑ a b c d e f L. E. Overman; M. Kakimoto. Carbon-Carbon Bond Formation via Directed 2-Azonia-[3,3]-Sigmatropic Rearrangements. A New Pyrrolidine Synthesis. Journal of the American Chemical Society. 1979, s. 1310–1312. doi:10.1021/ja00499a058.
- ↑ a b c d L. E. Overman; M. Kakimoto; M. Kakimoto. Directed 2-azonia-[3,3]-sigmatropic rearrangements. a convenient preparation of substituted 1-azaspiro[4,5]decanes. Tetrahedron Letters. 1979, s. 4041–4044. doi:10.1016/s0040-4039(01)86498-4.
- ↑ A. Armstrong; J. Levin; L. E. Overman. aza-Prins-pinacol approach to 7-azabicyclo[2.2.1]heptanes and ring expansion to [3.2.1]tropanes. Organic Letters. 2005, s. 1335. doi:10.1021/ja00221a037.
- ↑ a b c d R. B. Woodward; M. P. Cava; W. D. Ollis; A. Hunger; H. U. Daeniker; K. Schenker. The total synthesis of strychnine. Tetrahedron. 1963, s. 247–288. doi:10.1016/S0040-4020(01)98529-1. PMID 13305562.
- ↑ S. D. Knight; L. E. Overman; G. Pairaudeau. Synthesis applications of cationic aza-Cope rearrangements. 26. Enantioselective total synthesis of (−)-strychnine. Journal of the American Chemical Society. 1993, s. 9293–9294. doi:10.1021/ja00073a057.
- ↑ a b L. E. Overman; S. Sugai. Total Synthesis of (−)-Crinine. Use of Tandem Cationic Aza-Cope Rearrangement/Mannich Cyclizations for the Synthesis of Enantiomerically Pure Amaryllidaceae Alkaloids. Helvetica Chimica Acta. 1985, s. 745–749. doi:10.1002/hlca.19850680324.
- ↑ a b M. Brueggemann; A. I. McDonald; L. E. Overman; M. D. Rosen; L. Schwink; J. P. Scott. Total Synthesis of (±)-Didehydrostemofoline (Asparagamine A) and (±)-Isodidehydrostemofoline. Journal of the American Chemical Society. 2003, s. 15 284 – 15 285. doi:10.1021/ja0388820. PMID 14664560.
- ↑ L. E. Overman; J. Shim. Synthesis applications of cationic aza-Cope rearrangements. Part 25. Total synthesis of Amaryllidaceae alkaloids of the 5,11-methanomorphanthridine type. Efficient total syntheses of (−)-pancracine and (.+-.)-pancracine. Organic Reactions. 1993, s. 4662–4672. doi:10.1021/jo00069a032.
- ↑ a b c d L. E. Overman; M. Kakimoto; M. E. Okazaki; G. P. Meier. Synthesis applications of aza-Cope rearrangements. 11. Carbon-carbon bond formation under mild conditions via tandem cationic aza-Cope rearrangement-Mannich reactions. A convenient synthesis of polysubstituted pyrrolidines. Journal of the American Chemical Society. 1983, s. 6622–6629. doi:10.1021/ja00360a013.
- ↑ L. E. Overman; C. Fukaya. Stereoselective total synthesis of (.+-.)-perhydrogephyrotoxin. Synthetic applications of directed 2-azonia-[3,3]-sigmatropic rearrangements. Journal of the American Chemical Society. 1980, s. 1454–1456. doi:10.1021/ja00524a057.
- ↑ R. F. Borch; M. D. Bernstein; H. D. Durst. Cyanohydridoborate anion as a selective reducing agent. Journal of the American Chemical Society. 1971, s. 2897–2904. doi:10.1021/ja00741a013.
- ↑ D. S. Grierson; M. Harris; H. P. Husson. Synthesis and chemistry of 5,6-dihydropyridinium salt adducts. Synthons for general electrophilic and nucleophilic substitution of the piperidine ring system. Journal of the American Chemical Society. 1980, s. 1064–1082. doi:10.1021/ja00523a026.
- ↑ a b c L. E. Overman; E. J. Jacobsen. The cyanomethyl group for nitrogen protection and iminium ion generation in ring-enlarging pyrrolidine annulations. A short synthesis of the amaryllidaceae alkaloid d,1-crinine. Tetrahedron Letters. 1982, s. 2741–2744. doi:10.1016/S0040-4039(00)87446-8.
- ↑ a b c d Archivovaná kopie. www.chem.uky.edu [online]. [cit. 2020-12-30]. Dostupné v archivu pořízeném z originálu dne 2015-09-23.
- ↑ a b c S. Jolidon; H. J. Hansen. Untersuchungen über aromatische Amino-Claisen-Umlagerungen. Helvetica Chimica Acta. 1997, s. 978–1032. doi:10.1002/hlca.19770600329.
- ↑ Ehsan Zahedi; Safa Ali-Asgari; Keley Vahid. NBO and NICS analysis of the allylic rearrangements (the Cope and 3-aza-Cope rearrangements) of hexa-1,5-diene and N-vinylprop-2-en-1-amine: A DFT study. Central European Journal of Chemistry. 2010, s. 1097–1104. doi:10.2478/s11532-010-0084-1.
- ↑ Kent Brannock; Robert Burpitt. Notes- The Chemistry of Isobutenylamines. II. Alkylation with Allylic and Benzyl Halides. The Journal of Organic Chemistry. 1961, s. 3576–3577. doi:10.1021/jo01067a64.
- ↑ E. W. Baxter; D. Labaree; H. L. Ammon; P. S. Mariano. Formal total synthesis of deserpidine demonstrating a versatile amino-Claisen rearrangement/Wenkert cyclization strategy for the preparation of functionalized yohimbane ring systems. Journal of the American Chemical Society. 1990, s. 7682–7692. doi:10.1021/ja00177a032.
- ↑ R. K. Hill; N. W. Gilman. A nitrogen analog of the Claisen rearrangement. Tetrahedron Letters. 1967, s. 1421–1423. doi:10.1016/S0040-4039(00)71596-6.
- ↑ R. K. Boeckman; M. D. Shair; R. J. Vargas; L. A. Stolz. Synthetic and Mechanistic Studies of the retro-Claisen Rearrangement. 2. A Facile route to Medium-Ring Heterocycles via Rearrangement of Vinylcyclopropane- and Cyclobutanecarboxaldehydes. The Journal of Organic Chemistry. 1993, s. 1295–1297. doi:10.1021/jo00058a001.
Externí odkazy
 Obrázky, zvuky či videa k tématu Aza-Copeův přesmyk na Wikimedia Commons
Obrázky, zvuky či videa k tématu Aza-Copeův přesmyk na Wikimedia Commons
Média použitá na této stránce
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
strychnine final retrosynth
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
stereochem E vs Z aza cope
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
seven membered aza cope final
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
aza-cope intropicture final
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
ring strain 1 aza cope
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
zwitterionic 3 aza cope final
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
cationic 2 aza cope final general
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
oxazolidines final aza cope
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
aza cope aza prins final
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
AzaCopeMannich generic
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
precursors to strychnine final
(c) User:Ramurphy081, CC BY-SA 3.0
epoxide ring opening aza cope final
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
bond rotation aza cope
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
tricyclic final
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
strychnine aza cope step finalll
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
sm scope aza cope final
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
stereochem anti vs syn on ring aza cope
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
organolithium addition
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Horowitz geissman first aza cope 2
(c) User:Ramurphy081, CC BY-SA 3.0
diradical transition state aza cope
(c) Ramurphy081 na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
horowitz geissman final
![[1,2] a [1,3] aza-Copeovy přesmyky](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ee/Aza-cope_intropicture_final.tiff/lossy-page1-568px-Aza-cope_intropicture_final.tiff.jpg)