Azid rubidný
| Azid rubidný | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Azid rubidný |
| Anglický název | Rubidium azide |
| Německý název | Rubidiumazid |
| Sumární vzorec | RbN3 |
| Vzhled | bezbarvé jehličky[1] |
| Identifikace | |
| Registrační číslo CAS | 22756-36-1 |
| PubChem | 89824 |
| SMILES | [N-]=[N+]=[N-].[Rb+] |
| InChI | InChI=1S/N3.Rb/c1-3-2;/q-1;+1 |
| Vlastnosti | |
| Molární hmotnost | 127,49 g/mol |
| Teplota tání | 317–321 °C (590–594 K)[2][3] |
| Hustota | 2,79 g/cm3[1][2] |
| Rozpustnost ve vodě | 0,182 g/100 ml (16 °C, ethanol)[4] |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −0,1 kJ/mol[2] |
| Bezpečnost | |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Azid rubidný je anorganická sloučenina se vzorcem RbN3.[5] Jedná se o rubidiovou sůl kyseliny azidovodíkové (HN3). Stejně jako většina azidů je výbušný.[6]
Příprava
Azid rubidný lze připravit reakcí mezi síranem rubidným a azidem barnatým, při níž vzniká snadno oddělitelný nerozpustný síran barnatý:[7]
Rb2SO4 + Ba(N3)2 → 2 RbN3 + BaSO4
Nejméně v jedné studii byl azid rubidný připraven reakcí mezi butylnitritem, monohydrátem hydrazinu a hydroxidem rubidným:
Tento postup se obvykle používá k syntéze azidu draselného z hydroxidu draselného.[8]
Využití
Azid rubidný byl zkoumán pro možné použití v alkalických článcích, které jsou součástí atomových hodin, atomových magnetometrů a atomových gyroskopů. Azidy jsou žádoucími výchozími materiály, protože se při vystavení UV světlu rozkládají na kovové rubidium a plynný dusík.[9]
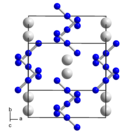
Struktura
Při pokojové teplotě má azid rubidný stejnou strukturu jako hydrogendifluorid draselný; jde o deformovanou strukturu chloridu cesného. Při teplotě 315 °C a tlaku 1 atm přechází azid rubidný na normální strukturu chloridu cesného.[6]
Azid rubidný má vysokotlaký strukturní přechod, ke kterému dochází při tlaku přibližně 4,8 kilobaru při teplotě 0 °C.[6]
Reakce
Stejně jako všechny azidy se při zahřátí rozkládá a uvolňuje plynný dusík:
Nebezpečí
Při tlaku 4,1 kilobaru a teplotě přibližně 460 °C se azid rubidný explozivně rozkládá.[6] Za normálních okolností exploduje při teplotě 395 °C.[10] Rozkládá se také při vystavení ultrafialovému záření.[9]
Azid rubidný je velmi citlivý na mechanické nárazy, jeho citlivost na náraz je srovnatelná s citlivostí TNT.[11]
Stejně jako všechny azidy je azid rubidný toxický.
Reference
V tomto článku byl použit překlad textu z článku Rubidium azide na anglické Wikipedii.
- ↑ a b DALE, Perry. Handbook of Inorganic Compounds. [s.l.]: [s.n.], 1995. Dostupné online. ISBN 9780849386718. S. 333.
- ↑ a b c HART, William; BEUMEL, O. F.; WHALEY, Thomas. The Chemistry of Lithium, Sodium, Potassium, Rubidium, Cesium and Francium: Pergamon Texts in Inorganic Chemistry. [s.l.]: Pergamon Press, 2013. Dostupné online. ISBN 9781483187570. S. 438.
- ↑ PICTORIUS, Carl W. F. T. Phase Diagrams to High Pressures of the Univalent Azides Belonging to the Space Group D 4hI8-14/mcm [online]. 1968-12-27 [cit. 2022-06-03]. Dostupné v archivu pořízeném dne 2022-02-22.
- ↑ HALA, Jiří. IUPAC-NIST Solubility Data Series. 79. Alkali and Alkaline Earth Metal Pseudohalides [online]. Národní institut standardů a technologie, 2022-08-23 [cit. 2022-08-23]. Dostupné v archivu pořízeném z originálu dne 2018-02-01. (anglicky)
- ↑ HRNČÍŘ, Jan. Sloučeniny [online]. Liberec: Gymnázium F. X. Šaldy [cit. 2022-06-03]. Dostupné online.
- ↑ a b c d PICTORIUS, Carl W. F. T. Phase Diagrams to High Pressures of the Univalent Azides Belonging to the Space Group D 4hI8-14/mcm [PDF]. 1968-12-27 [cit. 2022-06-03]. S. 1, 4, 5. Dostupné v archivu pořízeném dne 2022-02-22.
- ↑ HALA, Jiří. IUPAC-NIST Solubility Data Series. 79. Alkali and Alkaline Earth Metal Pseudohalides [online]. Národní institut standardů a technologie, 2002-08-23 [cit. 2022-06-03]. Dostupné v archivu pořízeném z originálu dne 2018-02-01.
- ↑ OGDEN, J. Steven; DYKE, John M.; LEVASON, William, Francesco Ferrante, Laura Gagliardi. The Characterisation of Molecular Alkali-Metal Azides. Chemistry - A European Journal. S. 3580–3586. doi:10.1002/CHEM.200501101. PMID 16491492.
- ↑ a b KARLEN, Sylvain; GOBET, Jean; OVERSTOL, Thomas, Jacques Haesler, Steve Lecomte. Lifetime assessment of RbN3-filled MEMS atomic vapor cells with Al2O3 coating. Optics Express. S. 2187–2194. doi:10.1364/OE.25.002187. PMID 29519066.
- ↑ HART, William A.; BEUMEL, O. F.; WHALEY, Thomas P. The Chemistry of Lithium, Sodium, Potassium, Rubidium, Cesium and Francium: Pergamon Texts in Inorganic Chemistry. [s.l.]: Pergamon Press, 2013. ISBN 9781483187570. S. 438.
- ↑ BABU, K. Ramesh; VAITHEESWARAN, G. Structure, elastic and dynamical properties of KN3 and RbN3: A van der Waals density functional study. Solid State Sciences. Advanced Centre of Research in High Energy Materials (ACRHEM), University of Hyderabad. S. 17–25. doi:10.1016/j.solidstatesciences.2013.05.017.
Média použitá na této stránce
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Autor: Andif1, Licence: CC BY-SA 4.0
Unit cell of rubidium azide. Created using Diamond 4. Data from Mueller, U. Verfeinerung der Kristallstrukturen von K N3, Rb N3, Cs N3 und Tl N3 Zeitschrift fuer Anorganische und Allgemeine Chemie, 392, 159-166 (1972)
Autor: WhittleMario, Licence: CC BY-SA 4.0
A two-dimensional structure of a molecule of rubidium azide, RbN3.