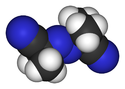
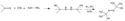Azobisizobutyronitril
| Azobisizobutyronitril | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 2,2′-azobis(2-methylpropannitril) |
| Ostatní názvy | AIBN |
| Sumární vzorec | C8H12N4 |
| Vzhled | bílá pevná látka[1] |
| Identifikace | |
| Registrační číslo CAS | 78-67-1 |
| EC-no (EINECS/ELINCS/NLP) | 201-132-3 |
| PubChem | 6547 |
| SMILES | CC(C)(C#N)N=NC(C)(C)C#N |
| InChI | InChI=1S/C8H12N4/c1-7(2,5-9)11-12-8(3,4)6-10/h1-4H3 |
| Vlastnosti | |
| Molární hmotnost | 164,21 g/mol |
| Teplota tání | 101,5 °C (374,6 K)[1] |
| Teplota rozkladu | 107 °C (380 K)[1] |
| Hustota | 1,1 g/cm3[1] |
| Rozpustnost ve vodě | nerozpustný[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v methanolu a ethanolu[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H242 H302 H332 H412[1] |
| P-věty | P210 P220 P234 P261 P264 P270 P271 P273 P280 P301+312 P304+312 P304+340 P312 P330 P372+378 P403+235 P411 P420 P501[1] |
Některá data mohou pocházet z datové položky. | |
Azobisisobutyronitril (zkráceně AIBN) je organická sloučenina se vzorcem [(CH3)2C(CN)]2N2, jde o bílý prášek rozpustný v alkoholech a dalších běžných organických rozpouštědlech, ovšem nerozpustný ve vodě. Používá se k tvorbě pěny u plastů a jako radikálový iniciátor.
Radikály vytvořené pomocí AIBN mají oproti organickým peroxidům několik výhod.[2] Nevytvářejí oxygenované vedlejší produkty ani nezpůsobují odbarvení. Jsou také vhodnější k použití v lepidlech, akrylátových barvách a v detergentech.
Mechanismus rozkladu
AIBN se za vyšších teplot rozkládá za odštěpení molekuly dusíku a tvorby dvou 2-kyanprop-2-ylových radikálů:
Protože azobisisobutyronitril snadno uvolňuje radikály, tak se často používá jako radikálový iniciátor. Tento rozklad nastává při teplotách nad 40 °C,[3] častěji se však provádí v rozmezí 66 °C až 72 °C.[4] ΔG‡ tohoto rozkladu činí 131 kJ/mol[4]. Uvolnění dusíku posunuje rovnováhu reakce ve prospěch produktů, protože se zvyšuje entropie. 2-kyan-2-propylový radikál je stabilizován −CN skupinami.
Reakce
Radikály vzniklé rozkladem AIBN mohou spouštět radikálové polymerizace i jiné radikálové reakce, například směs styrenu a maleinanhydridu v toluenu po zahřátí za přítomnosti AIBN vytvoří kopolymer. Další využití může tato látka mít při protimarkovnikovských hydrohalogenacích alkenů.
Benzylové bromace
AIBN lze použít jako radikálový iniciátor Wohlových–Zieglerových bromací.
Reakce AIBN s tributylcínem
Reakce
2-Kyan-2-propylové radikály vytvořené rozkladem azobisizobutyronitrilu mohou odštěpit vodík z tributylcínu. Vznikají tím tributylcínové radikály, které lze využít v řadě různých reakcí, například při odštěpování bromu z alkenů.
Mechanismus
Hydrohalogenace alkenů
Reakce
Při hydrohalogenacích alkenů 2-kyan-2-propylové radikály vzniklé z AIBN odštěpí vodík z HBr a vytvoří tím radikál bromu. Tento radikál se následně naváže na alken. Hydrohalogenace za použití AIBN mají protimarkovnikovovskou regioselektivitu.
Mechanismus
Příprava
AIBN se připravuje reakcí acetonkyanhydrinu s hydrazinem a oxidací vzniklého produktu:[5]
- 2 (CH3)2C(CN)OH + N2H4 → [(CH3)2C(CN)]2N2H2 + 2 H2O
- [(CH3)2C(CN)]2N2H2 + Cl2 → [(CH3)2C(CN)]2N2 + 2 HCl
Podobné vlastnosti mají i obdobné azosloučeniny, jako je 1,1′-azobis(cyklohexankarbonitril) (ABCN). Jsou také známy azoiniciátory rozpustné ve vodě.[6][7]
Další způsoby přípravy AIBN
AIBN lze rovněž získat níže uvedenou reakcí.[8]
Bezpečnost
AIBN je bezpečnější než benzoylperoxid, protože nebezpečí výbuchu je mnohem nižší; stále je ovšem považován za výbušninu, rozkládající se při teplotách nad 65 °C. Pyrolýza AIBN bez zachytávání 2-kyanpropylových radikálů vede k tvorbě vysoce toxického tetramethylsukcinonitrilu.
Reference
V tomto článku byl použit překlad textu z článku Azobisisobutyronitrile na anglické Wikipedii.
- ↑ a b c d e f g h i https://pubchem.ncbi.nlm.nih.gov/compound/6547
- ↑ AIBN initiator and other azo initiators. (n.d.). Retrieved from https://polymerchemistry.nouryon.com/products-applications/acrylic-polymer-initiators/aibn/
- ↑ 2,2′-Azobis(2-methylpropionitrile) 441090. (n.d.). Retrieved from https://www.sigmaaldrich.com/catalog/product/aldrich/441090?lang=en®ion=US
- ↑ a b Clayden, J., Greeves, N., & Warren, S. (2017). Organic chemistry. MTM
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. Příprava vydání Wiley-VCH. 1. vyd. [s.l.]: Wiley Dostupné online. ISBN 978-3-527-30385-4, ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a13_177. (anglicky) DOI: 10.1002/14356007.
- ↑ Vazo Product Grades [online]. [cit. 2021-11-09]. Dostupné v archivu pořízeném dne 2009-03-26.
- ↑ Archivovaná kopie. www.wako-chem.co.jp [online]. [cit. 2021-11-09]. Dostupné v archivu pořízeném z originálu dne 2016-03-05.
- ↑ Overberger, C. G., O'Shaughnessy, M. T., & Shalit, H. (1949). The Preparation of Some Aliphatic Azo Nitriles and their Decomposition in Solution. Journal of the American Chemical Society, 71(8), 2661-2666. doi:10.1021/ja01176a018
Externí odkazy
 Obrázky, zvuky či videa k tématu Azobisizobutyronitril na Wikimedia Commons
Obrázky, zvuky či videa k tématu Azobisizobutyronitril na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Autor: Lexiso, Licence: CC BY-SA 4.0
AIBN and Tributyltin Hydride (HSnBu3) Reaction
Structural formula of AIBN.
Autor: Lexiso, Licence: CC BY-SA 4.0
Hydrohalogenation of Alkene Reaction
Formation of radicals from AIBN
Autor: Lexiso, Licence: CC BY-SA 4.0
AIBN and Tributyltin Hydride (HSnBu3) Mechanism
Autor: Lexiso, Licence: CC BY-SA 4.0
Hydrohalogenation of Alkene Mechanism