Baeyerova–Villigerova oxidace
Baeyerova–Villigerova oxidace je organická reakce, při níž vzniká ester z acyklického nebo lakton z cyklického ketonu při použití peroxykyseliny nebo peroxidu jako oxidačního činidla.[1] Je pojmenována po Adolfu von Baeyerovi a Victoru Villigerovi, německých chemicích, kteří ji roku 1899 objevili.[1]

Mechanismus
U Baeyerovy–Villigerovy oxidace nejprve peroxykyselina protonuje kyslíkový atom karbonylové skupiny,[1] karbonyl je tak mnohem náchylnější k ataku peroxykyselinou.[1] Následně peroxykyselina atakuje uhlík tohoto karbonylu za vzniku meziproduktu nazývaného Criegeeův meziprodukt.[1] Poté se jeden ze substituentů ketonové skupiny přesune na kyslíkový atom peroxidové skupiny a uvolní se karboxylová kyselina;[1] právě tento krok ovlivňuje rychlost reakce.[2] Nakonec dojde k deprotonaci oxokarbeniového iontu a vzniku konečného esteru.[1]

Tvorba konkrétních produktů je pravděpodobně řízena primárními i sekundárními stereoelektronovými jevy.[3] Primární souvisejí s nutností, aby byla vazba mezi atomy kyslíku v peroxidu v opačné rovině než skupina, která se přesunuje;[3] takováto orientace umožňuje ideální překryv orbitalů σ přesunující se skupiny s orbitaly σ* peroxidové skupiny.[1] Sekundární stereoelektronové jevy souvisejí s potřebou, aby byl volný elektronový pár kyslíku v hydroxylové skupině v opačné rovině než skupina, která se přesunuje,[3] což umožňuje ideální překryv nevazebných orbitalů kyslíkového atomu hydroxylu s orbitaly σ* této skupiny.[4] Při tomto kroku dvě nebo tři molekuly peroxykyseliny pomáhají hydroxylovému protonu přesunout se do nové pozice.[5]

Schopnost přesunu klesá v této řadě: terciární skupina > sekundární skupina > aryl > primární skupina.[6] Allylové skupiny migrují lépe než primární alkyly, ovšem hůře než sekundární alkyly.[4] Pokud se na substituentu nachází skupina snižující elektronovou hustotu, pak se rychlost migrace snižuje,[7] pro což existují dvě možná vysvětlení.[8] Jedno z nich spočívá v tvorbě kladného náboje u přechodného stavu, což má za následek rozpad Criegeeova meziproduktu (jehož rezonanční struktury jsou zobrazeny na následujícím obrázku).[8] Vzhledem ke struktuře tohoto meziproduktu bude mít nejvyšší migrační schopnost meziprodukt s kladným nábojem.[8] Čím větší je úroveň substituce, tím je vzniklý karbokation obecně stabilnější[9] a proto se terciární skupiny přesunují lépe než sekundární a sekundární lépe než primární.

Při druhém možném vysvětlení se využívají stereoelektronové a sterické efekty.[10] Jak již bylo vysvětleno dříve, tak se přesouvá ten substituent, který je v přechodném stavu v antiperiplanární poloze vůči peroxidové skupině.[3] U tohoto přechodného stavu se objevují interakce mezi peroxykyselinou a skupinou, která se nepřesunuje, jež souvisejí s konformací přechodného stavu.[10] Pokud se objemnější skupina nachází vzhledem k peroxidové skupině v antiperiplanární poloze, tak dojde k omezení interakcí mezi vznikajícím esterem a karbonylem peroxykyseliny.[10] Objemnější skupina tedy bude „upřednostňovat“ peroxidovou skupinu, čímž se zvýší její náchylnost k přesunu.[10]

Historie
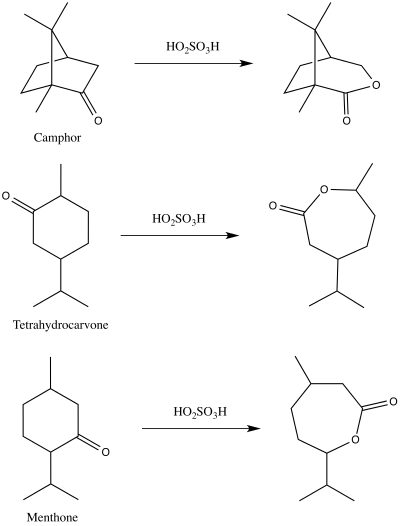
V roce 1899 Adolf Baeyer a Victor Villiger poprvé popsali reakci dnes známou pod názvem Baeyerova–Villigerova oxidace.[11][12] K tvorbě odpovídajících laktonů z kafru, menthonu a tetrahydrokarvonu použili kyselinu peroxosírovou.[12][13]
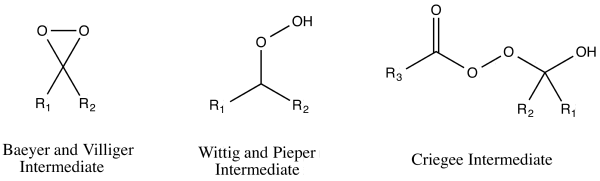
Byly navrženy tři mechanismy Baeyerovy–Villigerovy oxidace, které se zdály být v souladu s pozorováními.[14] Tyto mechanismy lze rozdělit na dva různé druhy peroxidového ataku podle toho, jestli k nim dochází na kyslíkovém či vodíkovém atomu karbonylové skupiny.[15] U ataku na kyslíkovém atomu mohou existovat dva různé meziprodukty; Baeyer a Villiger navrhli dioxiranový meziprodukt, zatímco Georg Wittig a Gustav Pieper navrhli tvorbu peroxidu (při které nevzniká dioxiran).[15] Rudolf Criegee předpokládal, že k ataku dochází na uhlíkovém atomu;[15] v tomto případě by peroxokyselina atakovala karbonylový uhlík za vzniku látky dnes nazývané Criegeeův meziprodukt.[15]
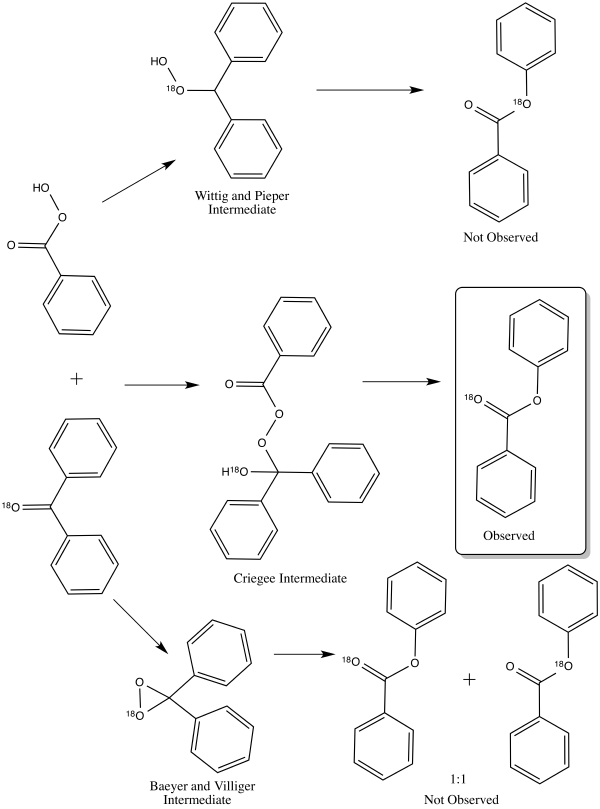
V roce 1953 William von Eggers Doering a Edwin Dorfman nalezli pomocí značení benzofenonu kyslíkem-18 správný mechanismus.[14] Každý ze tří navržených mechanismů vedl k rozdílnému rozložení značkovaných produktů. Criegeeův meziprodukt by vedl k produktu označkovanému pouze na karbonylovém kyslíku.[14] Produkt vzniklý z Wittigova-Pieperova meziproduktu by byl označen pouze na alkoxy skupině esteru.[14] Meziprodukt, který navrhli Baeyer a Villiger, by vedl k rovnocennému vzniku obou předchozích produktů.[14] Výsledek experimentu byl v souladu s tvorbou Criegeeova meziproduktu,[14] a nyní je přijímán jemu odpovídající mechanismus.[1]
Stereochemie
Přesun skupiny neovlivňuje stereochemii produktu.[16][17]
Reaktanty
Baeyerova–Villigerova oxidace provádí s mnoha různými peroxokyselinami, nejčastější jsou kyselina meta-chlorperoxybenzoová a kyselina trifluorperoctová.[2] Obecně platí, že se vyšší reaktivity dosahuje při nižší hodnotě disociační konstanty (tedy vyšší kyselosti) odpovídající karboxylové kyseliny (nebo alkoholu, pokud je k oxidaci použit peroxid).[4] Z tohoto důvodu reaktivita klesá v řadě kyselina trifluorperoctová > kyselina 4-nitroperoxobenzoová > kyselina meta-chlorperoxybenzoová > kyselina peroxyoctová > peroxid vodíku > terc-butylhydroperoxid.[4] Peroxidy jsou zde mnohem méně reaktivní než peroxokyseliny;[2] při použití peroxidu vodíku je často potřeba katalyzátor.[6][18] Použití organických peroxidů a peroxidu vodíku často způsobuje zvýšený výskyt vedlejších reakcí.[19]
Omezení
Používání peroxokyselin a peroxidů při Baeyerově–Villigerově oxidaci ketonů může vést k nechtěné oxidaci dalších funkčních skupin,[20] mimo jiné alkenů a aminů. Alkeny mohou být, obzvláště, je-li na nich vysoká elektronová hustota, oxidovány na epoxidy.[20][21] Byly ovšem vyvinuty metody, pomocí kterých se lze vyhnout těmto vedlejším reakcím.[20] Roku 1962 bylo popsáno, že při použití hydroperoxidu za přítomnosti selenového katalyzátoru dochází k tvorbě alkenylketonů, zatímco je-li použita kyselina peroxooctová, tak vzniká ester.[22]

Varianty
Katalytická Baeyerova–Villigerova oxidace
Použití peroxidu vodíku jako oxidačního činidla může být výhodné díky tomu, že je reakce šetrnější k životnímu prostředí, jelikož je jediným vedlejším produktem voda.[6] Reakce s katalyzátory tvořenými deriváty kyseliny benzenselenové mají při jeho použití značnou selektivitu.[23] Další skupinou katalyzátorů, které vykazují vysokou selektivitu při oxidaci peroxidem vodíku, jsou pevné Lewisovy kyseliny jako například křemičitany cínu.[24] Požadovanou aktivitu a plnou selektivitu vykazují hlavně křemičitany zeotypu Sn-beta a amorfní Sn-MCM-41.[25][26]
Baeyerovy–Villigerovy monooxygenázy
Jednou z variant Baeyerovy–Villigerovy oxidace je použití enzymů jako katalyzátorů.[6] Baeyerovy–Villigerovy monooxygenázy (BVMO) využívají k provedení této reakce dikyslík.[6] Zmíněné enzymy mohou enantioselektivně oxidovat prochirální substráty.[6]
Asymetrická Baeyerova–Villigerova oxidace
Proběhlo několik pokusů o využití organokovových katalyzátorů za účelem provedení enantioselektivní Baeyerovy–Villigerovy oxidace.[6] Prvním takovým popsaným způsobem byla oxidace prochirálního ketonu za použití dikyslíku jako oxidačního činidla a organické sloučeniny mědi jako katalyzátoru.[21] Následně byly použity i jiné katalyzátory, například sloučeniny platiny a hliníku.[21]
Využití
Syntéza zoapatanolu
Zoapatanol je biologicky aktivní látka, která se přirozeně vyskytuje v rostlině Montanoa tomentosa, z níž se v Mexiku připravuje odvar, který může spustit menstruaci.[27] Syntéza této látky byla popsána roku 1981;[28][29] byla při ní využita také Baeyerova–Villigerova oxidace, při níž vznikl lakton, který sloužil jako základní prvek, který vedl až k zoapatanolu.[28][29]
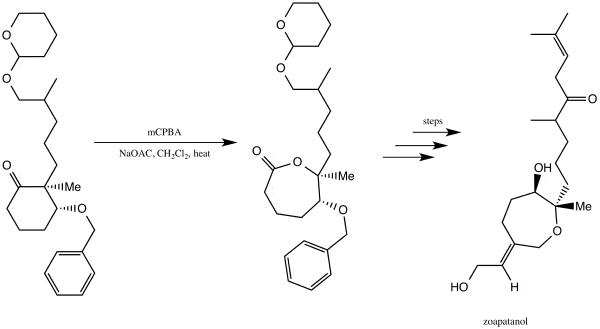
.
Syntéza steroidů
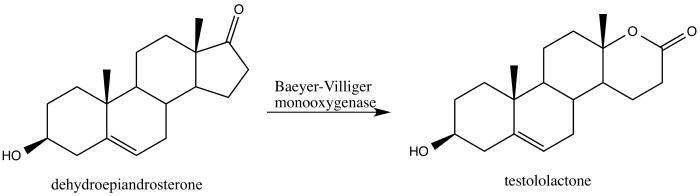
V roce 2013 byla popsána přeměna steroidu dehydroepiandrosteronu na léčivo testololakton za použití Baeyerovy–Villigerovy oxidace vyvolané houbou vytvářející Baeyerovu–Villigerovu monooxygenázu[30]
Odkazy
Související články
- Dakinova oxidace
Externí odkazy
 Obrázky, zvuky či videa k tématu Baeyerova–Villigerova oxidace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Baeyerova–Villigerova oxidace na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Baeyer–Villiger oxidation na anglické Wikipedii.
- ↑ a b c d e f g h i KÜRTI, László; CZAKÓ, Barbara. Strategic Applications of Named Reactions in Organic Synthesis. Burlington; San Diego; London: Elsevier Academic Press, 2005. ISBN 978-0-12-369483-6. S. 28. (anglicky)
- ↑ a b c KROW, Grant R. The Baeyer-Villiger Oxidation of Ketones and Aldehydes. Organic Reactions. 1993, s. 251–798. DOI 10.1002/0471264180.or043.03. (anglicky)
- ↑ a b c d CRUDDEN, Cathleen M.; CHEN, Austin C.; CALHOUN, Larry A. A Demonstration of the Primary Stereoelectronic Effect in the Baeyer-Villiger Oxidation of α-Fluorocyclohexanones. Angewandte Chemie. 2000, s. 2851–2855. DOI 10.1002/1521-3773(20000818)39:16<2851::aid-anie2851>3.0.co;2-y. (anglicky)
- ↑ a b c d MYERS, Andrew G. Chemistry 115 Handouts: Oxidation [online]. Dostupné online. (anglicky)
- ↑ The Role of Hydrogen Bonds in Baeyer-Villiger Reactions Shinichi Yamabe and Shoko Yamazaki Journal of Organic Chemistry; 2007; 72(8) pp 3031–41; (Article) DOI:10.1021/jo0626562
- ↑ a b c d e f g TEN BRINK, G.-J.; ARENDS, W. C. E.; SHELDON, R. A. The Baeyer-Villiger Reaction: New Developments toward Greener Procedures. Chem. Rev.. 2004, s. 4105–4123. DOI 10.1021/cr030011l. (anglicky)
- ↑ Name Reactions of Functional Group Transformations. Redakce Li Jie Jack. Hoboken, NJ: Wiley-Interscience, 2007. (anglicky)
- ↑ a b c HAWTHORNE, M. Frederick; EMMONS, William D.; MCCALLUM, K. S. A Re-examination of the Peroxyacid Cleavage of Ketones. I. Relative Migratory Aptitudes. Journal of the American Chemical Society. 1958, s. 6393–6398. DOI 10.1021/ja01556a057. (anglicky)
- ↑ JONES, JR., Maitland; FLEMING, Steven A. Organic Chemistry. 4th. vyd. Canada: W. W. Norton & Company, 2010. ISBN 978-0-393-93149-5. S. 293. (anglicky)
- ↑ a b c d EVANS, D. A. Stereoelectronic Effects-2 [online]. Dostupné online. (anglicky)
- ↑ BAEYER, Adolf; VILLIGER, Victor. Einwirkung des Caro'schen Reagens auf Ketone. Ber. Dtsch. Chem. Ges.. 1899, s. 3625–3633. DOI 10.1002/cber.189903203151. (anglicky)
- ↑ a b HASSALL, C. H. The Baeyer-Villiger Oxidation of Aldehydes and Ketones. Organic Reactions. 1957, s. 73–106. DOI 10.1002/0471264180.or009.03. (anglicky)
- ↑ RENZ, Michael; MEUNIER, Bernard. 100 Years of Baeyer-Villiger Oxidations. European Journal of Organic Chemistry. 1999, s. 737–750. DOI 10.1002/(SICI)1099-0690(199904)1999:4<737::AID-EJOC737>3.0.CO;2-B. (anglicky)
- ↑ a b c d e f DOERING, W. von E.; DORFMAN, Edwin. Mechanism of the Peracid Ketone-Ester Conversion. Analysis of Organic Compounds for Oxygen-18. Journal of the American Chemical Society. 1953, s. 5595–5598. DOI 10.1021/ja01118a035. (anglicky)
- ↑ a b c d DOERING, W. von E.; SPEERS, Louise. The Peracetic Acid Cleavage of Unsymmetrical Ketones. Journal of the American Chemical Society. 1950, s. 5515–5518. DOI 10.1021/ja01168a041. (anglicky)
- ↑ TURNER, Richard B. Stereochemistry of the Peracid Oxidation of Ketones. Journal of the American Chemical Society. 1950, s. 878–882. DOI 10.1021/ja01158a061. (anglicky)
- ↑ GALLAGHER, T. F.; KRITCHEVSKY, Theodore H. Perbenzoic Acid Oxidation of 20-Ketosteroids and the Stereochemistry of C-17. Journal of the American Chemical Society. 1950, s. 882–885. DOI 10.1021/ja01158a062. (anglicky)
- ↑ CAVARZAN, Alessandra; SCARSO, Alessandro; SGARBOSSA, Paolo; MICHELIN, Rino A.; STRUKUL, Giorgio. Green Catalytic Baeyer–Villiger Oxidation with Hydrogen Peroxide in Water Mediated by Pt(II) Catalysts. ChemCatChem. 2010, s. 1296–1302. DOI 10.1002/cctc.201000088. (anglicky)
- ↑ B. Schweitzer-Chaput, T. Kurtén, M. Klussmann, Angew. Chem. Int. Ed. 2015, 54, 11848–11851. DOI:10.1002/anie.201505648
- ↑ a b c Grant R. Krow. Comprehensive Organic Synthesis - Selectivity, Strategy and Efficiency in Modern Organic Chemistry, Volumes 1 - 9. Redakce Trost Barry M.. [s.l.]: Elsevier, 1991. Dostupné online. ISBN 978-0-08-035930-4. S. 671–688. (anglicky)
- ↑ a b c SEYMOUR, Craig. Page 1 The Asymmetric Baeyer-Villiger Oxidation [online]. Dostupné online. (anglicky)
- ↑ PAYNE, G. B. A Simplified Procedure for Epoxidation by Benzonitrile-Hydrogen Peroxide. Selective Oxidation of 2-Allylcyclohexanone. Tetrahedron. 1962, s. 763–765. DOI 10.1016/S0040-4020(01)92726-7. (anglicky)
- ↑ TEN BRINK, Gerd-Jan; VIS, Jan-Martijn; ARENDS, Isabel W. C. E.; SHELDON, Roger A. Selenium-Catalyzed Oxidations with Aqueous Hydrogen Peroxide. 2. Baeyer−Villiger Reactions in Homogeneous Solution. Journal of Organic Chemistry. 2001, s. 2429–2433. DOI 10.1021/jo0057710. (anglicky)
- ↑ FERRINI, Paola; DIJKMANS, Jan; CLERCQ, Rik De; VYVER, Stijn Van de; DUSSELIER, Michiel; JACOBS, Pierre A.; SELS, Bert F. Lewis acid catalysis on single site Sn centers incorporated into silica hosts. Coordination Chemistry Reviews. S. 220–255. Dostupné online. DOI 10.1016/j.ccr.2017.05.010. (anglicky)
- ↑ CORMA, A; NAVARRO, MT; NEMETH, L; RENZ, M. Sn-MCM-41—a heterogeneous selective catalyst for the Baeyer-Villiger oxidation with hydrogen peroxide. Chemical Communications. 7 November 2001, s. 2190-1. ISSN 1364-548X. DOI 10.1039/B105927K. PMID 12240094. (anglicky)
- ↑ RENZ, M; BLASCO, T; CORMA, A; FORNÉS, V; JENSEN, R; NEMETH, L. Selective and shape-selective Baeyer-Villiger oxidations of aromatic aldehydes and cyclic ketones with Sn-beta zeolites and H2O2. Chemistry. 18 October 2002, s. 4708-17. ISSN 1521-3765. DOI 10.1002/1521-3765(20021018)8:20<4708::AID-CHEM4708>3.0.CO;2-U. PMID 12561111. (anglicky)
- ↑ LEVINE, Seymour D.; ADAMS, Richard E.; CHEN, Robert; COTTER, Mary Lou; HIRSCH, Allen F.; KANE, Vinayak V.; KANOJIA, Ramesh M. Zoapatanol and Montanol, Novel Oxepane Diterpenoids, from the Mexican Plant Zoapatle (Montanoa tomentosa). Journal of the American Chemical Society. 1979, s. 3405–3407. DOI 10.1021/ja00506a057. (anglicky)
- ↑ a b KANE, Vinayak V.; DOYLE, Donald L. Total Synthesis of (±) Zoapatanol: A Stereospecific Synthesis of a Key Intermediate. Tetrahedron Lett.. 1981, s. 3027–3030. DOI 10.1016/S0040-4039(01)81818-9. (anglicky)
- ↑ a b KANE, Vinayak V.; DOYLE, Donald L. Total Synthesis of (±) Zoapatanol. Tetrahedron Letters. 1981, s. 3031–3034. DOI 10.1016/S0040-4039(01)81819-0. (anglicky)
- ↑ ŚWIZDOR, Alina. Baeyer-Villiger Oxidation of Some C19 Steroids by Penicillium lanosocoeruleum. Molecules. 2013, s. 13812–13822. DOI 10.3390/molecules181113812. (anglicky)
Média použitá na této stránce
Autor: AaronRosenbloom, Licence: CC0
Stereoelectronics of Criegee Intermediate
Autor: AaronRosenbloom, Licence: CC0
Dehydroepiandrosterone to testololactone
Autor: AaronRosenbloom, Licence: CC0
Baeyer-Villiger oxidation reaction mechanism
Autor: AaronRosenbloom, Licence: CC0
Original Baeyer-Villiger oxidation reactions
Autor: AaronRosenbloom, Licence: CC0
Criegee intermediate resonance structures
Autor: AaronRosenbloom, Licence: CC0
Baeyer-Villiger Oxidation Stereoelectronic Effects
Autor: AaronRosenbloom, Licence: CC0
Proposed Baeyer Villiger Intermediates
Autor: AaronRosenbloom, Licence: CC0
Dorfman and Doering's Labelling Experiment










