Bartonova–McCombieova deoxygenace
Bartonova–McCombieova deoxygenace je organická reakce, ve které jsou hydroxylové funkční skupiny ve sloučeninách nahrazovány atomy vodíku za tvorby alkylových skupin.[1][2] Objevili ji britští chemici Derek Barton a Stuart W. McCombie.

Tato deoxygenace patří mezi radikálové substituce. Podobá se jí Bartonova dekarboxylace, při níž jsou reaktanty karboxylové kyseliny.
Mechanismus
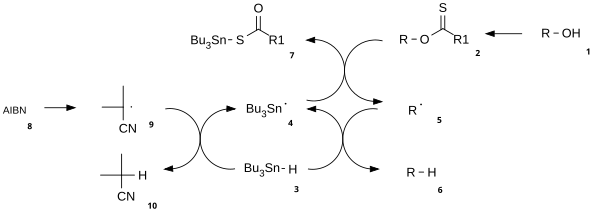
Mechanismus této reakce se skládá z katalytické radikálové iniciace a z propagace.[3]
Nejprve se alkohol (1) přemění na reaktivní karbonothioylový meziprodukt, jako je například thionoestery nebo xantáty 2. Zahřívání azobisizobutyronitrilu (AIBN) vede k jeho homolytickému štěpení, čímž vzniknou dva 2-kyanoprop-2-ylové radikály 9, přičemž každý odštěpí jeden proton z tributylstannanu 3 za vzniku tributylstannylových radikálů 4 a neaktivní sloučeniny 10. Tributylcínový radikál vyvolá oddělení xantátu od 2 atakem 4 na atomu síry a současně homolytické štěpení vazby π na síře. Tímto se vytvoří radikál s uhlíkatým centrem, jenž vytvoří vazbu π mezi uhlíkem a kyslíkem homolýzou σ vazby R-O, čímž se utvoří alkylový radikál 5 a tributylcínxantát 7. Vazba mezi atomy síry a cínu je zde velmi stabilní a představuje řídicí sílu reakce. Alkylový radikál 5 následně odštěpí atom vodíku z nové molekuly tributylstannanu a vytvoří konečný deoxygenovaný produkt (6) a nový radikál, který může vstoupit do propagace.
Obměny
Jiné zdroje vodíku
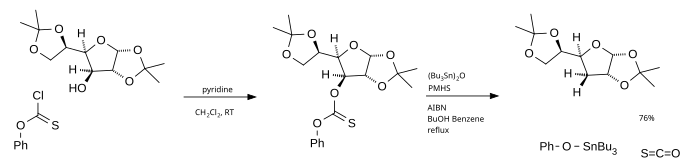
Hlavní nevýhodou Bartonovy–McCombieovy deoxygenace je použití tributylstannanu, který je toxický, nákladný a obtížně se odstraňuje z reakční směsi. Místo něj lze použít jako zdroj radikálů tributylcínoxid a poly(methylhydridsiloxan) (PMHS) jako zdroj vodíku.[4]
Při použití fenylchlorthionoformiátu jako výchozího materiálu se vytváří karbonylsulfid.
Trialkylborany
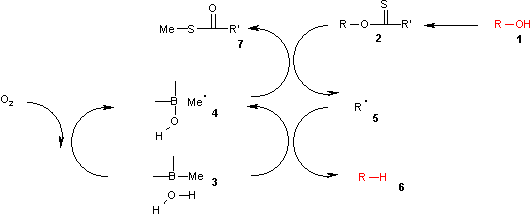
Ještě vhodnějšími donory vodíku jsou komplexy trialkylboranů s vodou.[5], například trimethylboran s příměsí malého množství vody.
V uvedeném katalytickém cyklu je reakce iniciována oxidací trialkylboranu 3 vzdušným kyslíkem na methylový radikál 4. Tento radikál reaguje s xantátem 2 na S-methyl-S-methyl dithiokarbonát 7 a radikálový meziprodukt 5. (CH3)3B.H2O komplex 3 poskytne vodík, který se rekombinuje s tímto radikálem za vzniku alkanu 6, přičemž se také vytvoří kyselina diethylborinová a nový methylový radikál.
Pomocí teoretických výpočtů bylo zjištěno, že homolýza vazby O-H v komplexu boranu a vody je endotermická a energie je podobná jako u homolýzy tributylstannanu, ovšem mnohem nižší než u homolýzy čisté vody.
Rozsah
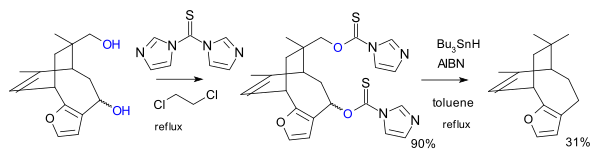
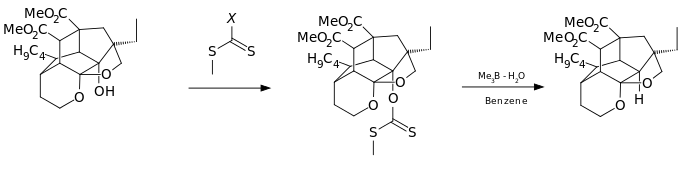
Varianta této reakce byla použita jako jeden z kroků totální syntézy azadirachtinu.[6]
V jiném případě byl reaktantem derivát imidazolu , konkrétně 1,1'-thiokarbonyldiimidazol (TCDI), použitý v rámci syntézy pallescensinu B.[7] TCDI je obzvláště vhodný u primárních alkoholů, protože nedochází k rezonanční stabilizaci xantátu, jelikož se volný elektronový pár dusíku zapojuje do aromatického sextetu.
Tento druh reakce lze také použít u S-alkylxantátů. Pomocí triethylboranu jako nekovového reaktantu jsou potřebné vodíkové atomy odštěpovány z protických rozpouštědel, stěny reaktoru nebo (ve zcela bezvodém prostředí) ze samotného boranu.[8]
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Bartonova–McCombieova deoxygenace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Bartonova–McCombieova deoxygenace na Wikimedia Commons - Barton-McCombie @ organic-chemistry.org
- Chemical & Engineering News [2]
Reference
V tomto článku byl použit překlad textu z článku Barton–McCombie deoxygenation na anglické Wikipedii.
- ↑ D. H. R. Barton; S. W. McCombie. A new method for the deoxygenation of secondary alcohols. Journal of the Chemical Society, Perkin Transactions 1. 1975, s. 1574–1585. DOI 10.1039/P19750001574.
- ↑ D. Crich; L. Quintero. Radical chemistry associated with the thiocarbonyl group. Chemical Reviews. 1989, s. 1413–1432. DOI 10.1021/cr00097a001.
- ↑ J. E. Forbes; S. Z. Zard. A novel radical chain reaction of xanthic anhydrides. Further observations on the intermediacy of alkoxy-thiocarbonyl radicals in the Barton-McCombie reaction. Tetrahedron Letters. 1989, s. 4367–4370. DOI 10.1016/s0040-4039(00)99362-6.
- ↑ J. Tormo; G. C. Fu. α-D-Ribo-hexofuranose, 3-deoxy-1,2:5,6-bis-O-(1-methylethylidene). Organic Syntheses. 2002, s. 239. DOI 10.15227/orgsyn.078.0239.
- ↑ Deoxygenation of Alcohols Employing Water as the Hydrogen Atom Source David A. Spiegel, Kenneth B. Wiberg, Laura N. Schacherer, Matthew R. Medeiros, and John L. Wood Journal of the American Chemical Society 2005, 127, 12513-12515. (DOI:10.1021/ja052185l)
- ↑ Synthesis of Azadirachtin: A Long but Successful Journey Gemma E. Veitch, Edith Beckmann, Brenda J. Burke, Alistair Boyer, Sarah L. Maslen, and Steven V. Ley Angew. Chem. Int. Ed. 2007, DOI: 10.1002/anie.200703027
- ↑ The first total synthesis of (±)-pallescensin B Wen-Cheng Liu and Chun-Chen Liao Chemical Communications, 1999, 117–118 117 [1]
- ↑ Part 2. Mechanistic aspects of the reduction of S-alkyl-thionocarbonates in the presence of triethylborane and air Allais F, Boivin J, Nguyen V Beilstein Journal of Organic Chemistry, 2007 3:45 (12 December 2007) DOI:10.1186/1860-5397-3-46
Média použitá na této stránce
Barton McCombie deoxygenation example 2
Mechanism for Barton-McCombie deoxygenation
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Barton Deoxygenation with thiocarbonyldiimidazole
Barton McCombie deoxygenation example 1
(c) V8rik from en.wikipedia.org, CC BY-SA 3.0
Barton-McCombie alkylborane mechanism
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Azadirachtin Reaction Sequence
Reaction scheme of the Barton-McCombie deoxygenation.