Benzylchlorid
| Benzylchlorid | |
|---|---|
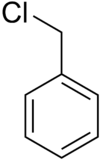 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | (chlormethyl)benzen |
| Sumární vzorec | C7H7Cl |
| Vzhled | bezbarvá až nažloutlá kapalina |
| Identifikace | |
| Registrační číslo CAS | 100-44-7 |
| PubChem | 7503 |
| SMILES | ClCc1ccccc1 |
| InChI | 1/C7H7Cl/c8-6-7-4-2-1-3-5-7/h1-5H,6H2 |
| Vlastnosti | |
| Molární hmotnost | 126,58 g/mol |
| Teplota tání | −39 °C (234 K) |
| Teplota varu | 179 °C (452 K) |
| Hustota | 1,100 g/cm3 |
| Index lomu | 1,5415 (15 °C) |
| Rozpustnost ve vodě | 0,05 g/100 ml (20 °C) |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru, chloroformu a tetrachlormethanu |
| Tlak páry | 0,8 kPa (20 °C) |
| Měrná magnetická susceptibilita | −6,48×105 μm3/g |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Teplota vzplanutí | 67 °C (340 K) |
| Teplota vznícení | 585 °C (858 K) |
| Meze výbušnosti | ≥1,1 % |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Benzylchlorid (systematický název (chlormethyl)benzen) je organická sloučenina se vzorcem C6H5CH2Cl. Tato bezbarvá kapalina se používá jako reaktant v chemickém průmyslu a v organické syntéze.
Výroba
Benzylchlorid se vyrábí fotochemickou reakcí plynného toluenu s chlorem:
- C6H5CH3 + Cl2 → C6H5CH2Cl + HCl
Reakce probíhá radikálovým mechanismem, přičemž jako meziprodukt vzniká atomární chlor; vedlejšími produkty jsou benzalchlorid a benzotrichlorid. Tímto způsobem se ročně vyrobí okolo 100 000 tun.
Existují i další metody, jako například Blancova chlormethylace benzenu. Benzylchlorid byl poprvé připraven z benzylalkoholu a kyseliny chlorovodíkové.
Použití a reakce
V průmyslu se benzylchlorid používá jako prekurzor benzylesterů, které jsou surovinami při výrobě plastifikátorů, aromat a vůní. Kyselina fenyloctová, používaná k výrobě léčiv, se získává z fenylacetonitrilu, jenž vzniká reakcí benzylchloridu s kyanidem sodným. Kvartérní amoniové soli, sloužící jako tenzidy, se získávají alkylací terciárních aminů benzylchloridem.
V organické syntéze se používá k připojení benzylové chránicí skupiny reakcí s alkoholy za vzniku příslušného benzyletheru, karboxylové kyseliny a benzylesteru. Kyselinu benzoovou lze připravit oxidací benzylchloridu pomocí manganistanu draselného v zásaditém prostředí:
- C6H5CH2Cl + 2 KOH + 2 [O] → C6H5COOK + KCl + H2O
Benzylchlorid je možné použít při přípravě amfetaminů. S kovovým hořčíkem reaguje za tvorby Grignardova činidla.[2] Je upřednostňován před benzylbromidem, který jako produkt dává 1,2-difenylethan.
Bezpečnost
Benzylchlorid je alkylační činidlo a díky své vysoké reaktivitě (srovnatelné jako u alkylchloridů) reaguje s vodou; produkty hydrolýzy, například při styku se sliznicemi, jsou benzylalkohol a kyselina chlorovodíková, kvůli čemuž má slzotvorné účinky a byl použit jako chemická zbraň. Rovněž silně dráždí kůži.
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Benzylchlorid na Wikimedia Commons
Obrázky, zvuky či videa k tématu Benzylchlorid na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Benzyl chloride na anglické Wikipedii.
- ↑ a b Benzyl chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ HENRY GILMAN AND W. E. CATLIN. n-Propylbenzene. Org. Synth.. 1941. Dostupné online. (anglicky); Coll. Vol.. S. 471. (anglicky)
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Chemical structure of benzyl chloride









