Beta-karbolin
| Beta-karbolin | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 9H-pyrido[3,4-b]indol |
| Ostatní názvy | norharman |
| Sumární vzorec | C11H8N2 |
| Identifikace | |
| Registrační číslo CAS | 244-63-3 |
| PubChem | 64961 |
| SMILES | c1ccc3c(c1)[nH]c2cnccc23 |
| InChI | InChI=1S/C11H8N2/c1-2-4-10-8(3-1)9-5-6-12-7-11(9)13-10/h1-7,13H |
| Vlastnosti | |
| Molární hmotnost | 168,19 g/mol |
| Teplota tání | 199 °C (472 K)[1] |
| Rozpustnost ve vodě | >2,52 g/100 ml[1] |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H302[1] |
| P-věty | P264 P270 P301+312 P310 P501[1] |
Některá data mohou pocházet z datové položky. | |
Beta-karbolin (také β-karbolin, systematický název 9H-pyrido[3,4-b]indol) je organická sloučenina patřící mezi dusíkaté heterocykly. Je základní stavební jednotkou indolových alkaloidů nazývaných β-karboliny.[2]
Farmakologické vlastnosti
β-Karbolinové alkaloidy se vyskytují v mnoha rostlinách i živočiších a často fungují jako inverzní agonisté GABAA. U liány Banisteriopsis caapi β-karboliny harmin, harmalin a tetrahydroharmin významně ovlivňují farmakologické vlastnosti ayahuascy tím, že reverzní inhibicí monoaminoxidázy zabraňují rozkladu dimethyltryptaminu, čímž vyvolávají psychoaktivní účinky. Některé β-karboliny, jako jsou tryptolin a pinolin, se mohou přirozeně tvořit v lidském těle. Pinolin pravděpodobně společně s melatoninem ovlivňuje cirkadiánní rytmus.[zdroj?] β-karbolin je inverzním agonistou GABAA benzodiazepinového receptoru a má tak konvulzivní a anxiogenní účinky a zlepšuje paměť.[3] 3-hydroxymethyl-beta-karbolin blokuje hypnotické účinky flurazepamu u hlodavců; tento jeho účinek závisí na dávce.[4] 9-methyl-β-karboliny při vystavení ultrafialovému záření vyvolávají poškození DNA.[5]
Struktura
Beta-karbolin patří mezi indolové alkaloidy, molekula se skládá z pyridinového kruhu zkondenzovaného s indolovou strukturou.[6] Struktura β-karbolinu je podobná jako u tryptaminu, navíc je zde ethylaminový řetězec, který dalším atomem uhlíku propojuje obě části a vytváří tricyklickou molekulu. Biosyntéza β-karbolinů pravděpodobně vychází z podobných tryptaminů.[7] Míra nasycení na třetím kruhu se může lišit, to je níže zobrazeno červeným a modrým obarvením možných dvojných vazeb:

Příklady beta-karbolinů
Některé významné β-karboliny jsou uvedeny v následující tabulce:
| Název | R1 | R6 | R7 | R9 | Structure | ||
|---|---|---|---|---|---|---|---|
| β-karbolin | × | × | H | H | H | H |  |
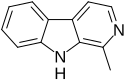
| Tryptolin | H | H | H | H | 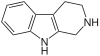 | ||
| Pinolin | H | OCH3 | H | H |  | ||
| Harman | × | × | CH3 | H | H | H |  |
| Harmin | × | × | CH3 | H | OCH3 | H | 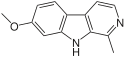 |
| Harmalin | × | CH3 | H | OCH3 | H |  | |
| Tetrahydroharmin | CH3 | H | OCH3 | H |  | ||
| 9-Methyl-β-karbolin | × | × | H | H | H | CH3 | 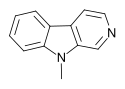 |
Výskyt
Je známo 64 různých β-karbolinových alkaloidů obsažených v rostlinách. Suchá semena harmaly stepní (Peganum harmala) obsahují 0,16[8] až 5,9 %[9] β-karbolinových alkaloidů.
V důsledku přítomnosti β-karbolinů v kutikule některých štírů jejich pokožka po vystavení určitým vlnovým délkám z ultrafialové oblasti fluoreskuje.[10] Skupina β-karbolinů nazývaná eudistominy se vyskytuje u sumek, jako jsou například Ritterella sigillinoides,[11] Lissoclinum fragile[12] a Pseudodistoma aureum.[13]
β-karboliny podporují tvorbu sekundárních metabolitů u půdních bakterií rodu “Streptomyces”.[14][15] Vznik sekundárních metabolitů ovlivňují řízením exprese biosyntetických genů vazbou na ATP-vazebné regulátory skupiny LuxR.
Odkazy
Související články
- Tryptamin
- Gama-karbolin
Externí odkazy
 Obrázky, zvuky či videa k tématu beta-karbolin na Wikimedia Commons
Obrázky, zvuky či videa k tématu beta-karbolin na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku beta-Carboline na anglické Wikipedii.
- ↑ a b c d e f 9H-Pyrido[3,4-B]indole. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Anna Bratchkova; Veneta Ivanova; Adriana Gousterova; Hartmut Laatsch. β-Carboline Alkaloid Constituents from a Thermoactinomyces SP. Strain Isolated from Livingston Island, Antarctica. Biotechnology & Biotechnological Equipment. 2014-04-16, s. 3005–3009. doi:10.5504/BBEQ.2012.0021.
- ↑ P. Venault; G. Chapouthier. From the behavioral pharmacology of beta-carbolines to seizures, anxiety, and memory. ScientificWorldJournal. 2007, s. 204–223. doi:10.1100/tsw.2007.48. PMID 17334612.
- ↑ W. Mendelson; M. Cain; J. Cook; S. Paul; P. Skolnick. A benzodiazepine receptor antagonist decreases sleep and reverses the hypnotic actions of flurazepam. Science. 1983-01-28, s. 414–416. ISSN 0036-8075. doi:10.1126/science.6294835. PMID 6294835. Bibcode 1983Sci...219..414M.
- ↑ M. Vignoni; F. A. Rasse-Suriani; K. Butzbach; R. Erra-Balsells; B. Epe; F. M. Cabrerizo. Mechanisms of DNA damage by photoexcited 9-methyl-β-carbolines. Organic and Biomolecular Chemistry. 2013, s. 5300–5309. doi:10.1039/c3ob40344k. PMID 23842892.
- ↑ The Encyclopedia of Psychoactive Plants: Ethnopharmacology and its Applications. Ratsch, Christian. Park Street Press c. 2005
- ↑ Jessica Baiget; Sabin Llona-Minguez; Stuart Lang; Simon P. MacKay; Colin J. Suckling; Oliver B. Sutcliffe. Manganese dioxide mediated one-pot synthesis of methyl 9H-pyrido[3,4-b]indole-1-carboxylate: Concise synthesis of alangiobussinine. Beilstein Journal of Organic Chemistry. 2011, s. 1407–1411. doi:10.3762/bjoc.7.164. PMID 22043251.
- ↑ B. Hemmateenejad; A. Abbaspour; H. Maghami; R. Miri; M. R. Panjehshahin. Partial least squares-based multivariate spectral calibration method for simultaneous determination of beta-carboline derivatives in Peganum harmala seed extracts. Analytica Chimica Acta. 2006, s. 290–299. doi:10.1016/j.aca.2006.05.093. PMID 17723604.
- ↑ T. Herraiz; D. González; C. Ancín-Azpilicueta; V. J. Arán; H. Guillén. beta-Carboline alkaloids in Peganum harmala and inhibition of human monoamine oxidase (MAO). Food and Chemical Toxicology. 2010, s. 839–843. doi:10.1016/j.fct.2009.12.019. PMID 20036304.
- ↑ S. J. Stachel; S. A. Stockwell; D. L. van Vranken. The fluorescence of scorpions and cataractogenesis. Cell Chemical Biology. 1999, s. 531–539. doi:10.1016/S1074-5521(99)80085-4. PMID 10421760.
- ↑ R. J. Lake; J. W. Blunt; M. H. Munro. Eudistomins from the New Zealand ascidian Ritterella sigillinoides. Australian Journal of Chemistry. 1989, s. 1201–1206. doi:10.1071/CH9891201.
- ↑ A. Badre; A. Boulanger; E. Abou-Mansour; B. Banaigs; G. Combaut; C. Francisco. Eudistomin U and isoeudistomin U, new alkaloids from the Caribbean ascidian Lissoclinum fragile. Journal of Natural Products. 1994, s. 528–533. doi:10.1021/np50106a016. PMID 8021654.
- ↑ R. A. Davis; A. R. Carroll; R. J. Quinn. Eudistomin V, a new β-carboline from the Australian ascidian Pseudodistoma aureum. Journal of Natural Products. 1998, s. 959–960. doi:10.1021/np9800452. PMID 9677285.
- ↑ S. Panthee; S. Takahashi; T. Hayashi; T. Shimizu; H. Osada. β-carboline biomediators induce reveromycin production in Streptomyces sp. SN-593. Scientific Reports. 2019-04-09, s. 5802. doi:10.1038/s41598-019-42268-w. PMID 30967594.
- ↑ S. Panthee; N. Kito; T. Hayashi; T. Shimizu; J. Ishikawa; H. Hamamoto; H. Osada. β-carboline chemical signals induce reveromycin production through a LuxR family regulator in Streptomyces sp. SN-593. Scientific Reports. 2020-06-23, s. 10230. doi:10.1038/s41598-020-66974-y. PMID 32576869.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
I made this in BKchem
I made this in BKchem
I made this with BKchem
Chemical diagram for variably substituted beta-carbolines
Autor: Tekmeme, Licence: CC BY-SA 3.0
Molecular structure of harmane, line diagram.
I made this with BKchem
structural diagram for 9-Methyl-β-carboline (i.e. 9-Me-BC, IUPAC name 9-Methylpyrido[3,4-b]indole) I made this using the open-source Python-based chemical structure drawing tool 'bkchem'
Skeletal formula of beta-carboline. Created using ACD/ChemSketch 10.0 and Inkscape.
I made this with BKchem
Autor: Mplanine, Licence: CC BY-SA 4.0
The prototype of a class of compounds known as β-carbolines.