Boronové kyseliny
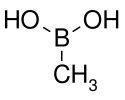
Boronové kyseliny jsou sloučeniny odvozené od kyseliny borité náhradou jedné ze tří hydroxylových skupin alkylovou nebo arylovou funkční skupinou.[1] Protože tyto sloučeniny obsahují vazbu mezi atomy uhlíku a boru, tak spadají mezi organoborany. Boronové kyseliny fungují jako Lewisovy kyseliny. Jsou jedinečné svou schopností vvratně vytvářet kovalentní komplexy například se sacharidy, aminokyselinami a hydroxyskořicovými kyselinami (molekulami obsahujícími 1,2- nebo 1,3-substituované Lewisovy zásady (alkoholy, aminy, karboxyláty). pKa kyseliny borité je ~9, boronové kyseliny ovšem mohou tvořit tetraedrické komplexy s pKa okolo 7. Používají se například k navazování sacharidů za účelem jejich fluorescenční detekce nebo selektivního transportu přes membrány.
Boronové kyseliny se používají jako stavební prvky a meziprodukty v organické syntéze, nejčastěji při Suzukiových reakcích. Jejich hlavním využitím jsou transmetalace jejich organických zbytků na přechodné kovy.
Sloučenina bortezomib, obsahující tento druh funkční skupiny, se používá při chemoterapii. Atom boru v této molekule blokuje funkci některých proteazomů, které by mohly rozkládat bílkoviny. Boronové kyseliny se vážou na serinová aktivní místa a jsou součástí prasečích inhibitorů pankreatické lipázy,[2] subtilisinu[3] a proteázy Kex2.[4] Deriváty boronových kyselin mohou také inhibovat lidské acylproteinthioesterázy 1 a 2, na které cílí protirakovinná léčiva ze skupiny ras.[5]
Boronové kyseliny mají nízkou toxicitu, což je jedním z důvodů oblíbenosti Suzukiových reakcí při vývoj i a výrobě léčiv. Velká část běžně používaných boronových kyselin a jejich derivátů ovšem vykazuje pozitivní Amesův test a má mutagenní účinky. Mutagenita je pravděpodobně způsobena tvorbou organických radikálů oxidací boronových kyselin vzdušným kyslíkem.[6]
Příprava a struktura
V roce 1860 popsal Edward Frankland přípravu a izolaci první boronové kyseliny, kyseliny ethylboronové. Nejprve provedl reakci diethylzinku s triethylboritanem za vzniku triethylboranu. Tato látka byla poté oxidována na vzduchu na kyselinu ethylboronovou.[7][8]
Nyní se používá několik různých syntetických postupů a komerčně dostupných je mnoho na vzduchu stálých boronových kyselin.
Boronové kyseliny mají obvykle vysoké teploty tání. Mají tendence tvořit anhydridy odštěpením molekul vody, často tak vznikají cyklické trimery.
| Kyselina | R | Struktura | Molární hmotnost | CAS | Teplota tání °C |
|---|---|---|---|---|---|
| Kyselina fenylboronová | Fenyl | (c) V8rik, CC BY-SA 3.0 | 121,93 | 98-80-6 | 216–219 |
| Kyselina 2-thienylboronová | Thiofen |  | 127,96 | 6165-68-0 | 138–140 |
| Kyselina methylboronová | Methyl |  | 59,86 | 13061-96-6 | 91–94 |
| Kyselina cis-propenylboronová | propen | 85,90 | 7547-96-8 | 65–70 | |
| Kyselina trans-propenylboronová | propen |  | 85,90 | 7547-97-9 | 123–127 |
Příprava
Boronové kyseliny lze získat několika způsoby; nejčastější je reakce organolithných či organohořečnatých sloučenin s estery kyseliny borité.[9][10][11][12]
Příkladem může být příprava kyseliny fenylboronové z fenylmagnesiumbromidu a trimethylborátu následovaná hydrolýzou[13]
- PhMgBr + B(OMe)3 → PhB(OMe)2 + MeOMgBr
- PhB(OMe)2 + H2O → PhB(OH)2 + MeOH
Další možností je transmetalační reakce arylsilanu (RSiR3) s bromidem boritým (BBr3) za vzniku RBBr2 a hydrolýza tohoto meziproduktu.
Třetí způsob spočívá v palladiem katalyzovaných reakcích arylhalogenidů a aryltriflátů s diboronovými estery; tato metoda se nazývá Mijaurova borylace. Místo esterů je možné použít diboronové kyseliny nebo tetrahydroxydibor ([B(OH2)]2).[14][15][16]
Boronové estery
Boronové estery (také nazývané boronátové estery) jsou estery vytvořené z boronových kyselin a alkoholů nebo fenolů.
| Sloučenina | Funkční vzorec | Strukturní vzorec |
|---|---|---|
| Boronová kyselina | RB(OH)2 |  |
| Ester kyseliny boronové | RB(OR)2 |  |
Tyto sloučeniny lze získat z borátových esterů kondenzací s jednosytnými alkoholy a dioly. Kyselina fenylboronová může podléhat autokondenzaci za vzniku cyklického trimeru nazývaného trifenylboroxin.[17]
| Boronový ester | Alkohol | Strukturní vzorec | Molární hmotnost | Číslo CAS | Teplota varu (°C) |
|---|---|---|---|---|---|
| Pinakolester kyseliny allylboronové | pinakol | 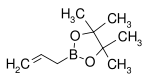 | 168,04 | 72824-04-5 | 50–53 (5 mmHg) |
| Trimethylenglykolester kyseliny fenylboronové | trimethylenglykol |  | 161,99 | 4406-77-3 | 106 (2 mmHg) |
| Diisopropoxymethylboran | isopropylalkohol |  | 144,02 | 86595-27-9 | 105 -107 |
Sloučeniny s pětičlennými cykly obsahujícími řetězce C–O–B–O–C se nazývají dioxaborolany a obdobné sloučeniny s šestičlennými cykly jsou dioxaborinany.
Využití v organické chemii
Suzukiovy reakce
Boronové kyseliny se používají při Suzukiových reakcích, kde atomy boru vyměňují své arylové skupiny s alkoxyskupinami navázanými na palladium.
: |
| () |
Chanovo–Lamovo párování
Při Chanově–Lamově párování reagují alkyl-, alkenyl-, nebo arylboronové kyseliny se sloučeninami obsahujícími vazby N–H nebo O–H za přítomnosti měďnaté soli, jako je například octan měďnatý, kyslíku a zásady (což může být například pyridin)[18][19] za vzniku nové vazby uhlík-dusík nebo uhlík–kyslík; příkladem může být následující reakce 2-pyridonu s kyselinou trans-1-hexenylboronovou:
Mechanismus reakce zahrnuje deprotonaci aminu, koordinaci aminu na měďnaté centrum, transmetalaci (přesun alkylboronové skupiny na měď a octanu měďnatého na bor), oxidaci Cu2+ na Cu3+ kyslíkem a redukčně eliminační přeměnu Cu3+ na Cu+ za vzniku konečného produktu. Probíhá také přímá redukční eliminace Cu2+ na Cu0, která je ovšem mnohem pomalejší. V katalytických systémech slouží kyslík také k obnově měďnatého katalyzátoru.
Liebeskindovo–Sroglovo párování
V Liebeskindově–Sroglově párování reagují thioestery s boronovými kyselinami za tvorby ketonů.
Konjugované adice
Organické zbytky boronových kyselin mohou fungovat jako nukleofily při konjugovaných adičních reakcích, pokud jsou přítomny kovy. Při jedné studii byla provedena reakce pinakolesteru allylboronové kyseliny s dibenzylidenacetonem:[20]
Dalším příkladem konjugované adice je reakce graminu s kyselinou fenylboronovou katalyzovaná dimerem cyklooktadienrhodiumchloridu:[21]
Oxidace
Boronové estery lze oxidovat na příslušné alkoholy za přítomnosti zásady a peroxidu vodíku.
Homologace
- Při homologacích boronových esterů se alkylové skupiny přesouvají z boru tvořícího boronát na atom uhlíku:[22]
- Homologace boronového esteru
- Využití homologace
Při těchto reakcích se používá dichlormethyllithium na přeměnu boronových esterů v boronáty. Lewisova kyselina následně spustí přesmyk alkylu za odštěpení jednoho chloru. Nakonec organokovová sloučenina, například Grignardovo činidlo, odštěpí druhý atom chloru a RCH2 skupina se naváže na vazbu C-B.
Další reakcí, která zahrnuje přesun alkylboronátu, je Petasisova reakce.
Elektrofilní allylové přesuny
Allylboronové estery se mohou zapojit do elektrofilních allylových přesmyků, podobně jako sloučeniny křemíku do Sakuraiových reakcí.[23]:
Hydrolýza
Hydrolýzu boronových esterů na příslušné boronové kyseliny a alkoholy je možné provést například se zapojením thionylchloridu a pyridinu.[24] Arylboronové kyseliny a estery mohou být hydrolyzovány na fenoly působením hydroxylaminu za pokojové teploty.[25]
C–H párovací reakce
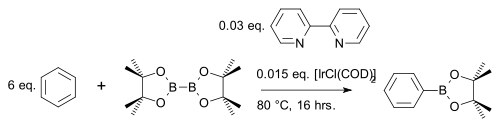
Sloučenina bis(pinakoláto)dibor[26] reaguje s aromatickými heterocykly[27] nebo jednoduchými areny[28] za tvorby arylboronátových esterů; katalyzátory jsou [IrCl(COD)2] (obměna Crabtreeova katalyzátoru) a zásada 4,4′-di-terc-butyl-2,2′-bipyridin:
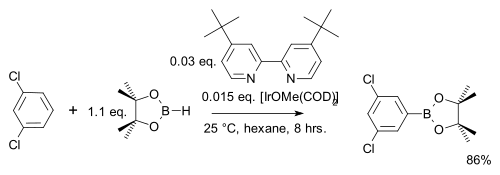
V jedné modifikaci této reakce se používá pouze stechiometrické množství arenu místo velkého přebytku a druhým reaktantem je namísto bis(pinakoláto)diboru levnější pinakolboran:[29]
Na rozdíl od běžné elektrofilní aromatické substituce, kde převažují elektronové efekty, zde regioselektivitu ovlivňují výhradně sterické vlastnosti iridiového komplexu. Příkladem je meta-bromace m, u které při běžné variantě vzniká ortho produkt:[30]
Protonolýza
Protodeborace je chemická reakce, při níž dochází k protonolýze boronové kyseliny (nebo jiné organoboranové sloučeniny) zánikem vazby uhlík-bor a jejím nahrazením vazbou uhlík-vodík. Protodeborace je nežádoucí vedlejší reakcí, často se objevuje při kovy katalyzovaných párovacích reakcích, do kterých jsou zapojené boronové kyseliny (jako je Suzukiova reakce). U dané boronové kyseliny je náchylnost k protodeboraci značně proměnlivá a závisí na mnoha faktorech, jako jsou reakční podmínky a organické substituenty navázané na kyselinu:

Využití v supramolekulární chemii
Rozlišování sacharidů

Kovalentní interakce mezi boronovými kyselinami a hydroxylovými skupinami, například v alkoholech a karboxylovými kyselinami ve vodných roztocích probíhají rychle a jsou vratné. Rovnováha mezi boronovou kyselinou a hydroxylovými skupinami sacharidů může být využita k tvorbě senzorů detekujících přítomnost sacharidů.[32] Jednou z hlavních výhod tohoto postupu je schopnost boronových kyselin překonat problémy spojené s navazováním neutrálních částic ve vodném prostředí.[33] Při správném uspořádání vede přidání terciárního aminu do těchto supramolekulárních systémů k jejich navazování při fyziologickém pH, což umožňuje využití signálních mechanismů, jako je fotoindukovaný přenos elektronu k řízené fluorescenci, která poskytuje údaje o navazování sloučenin.
Tuto metodu je možné použít například v systémech pro sledování obsahu glukózy v krvi u pacientů majících diabetes mellitus. Protože se zde využívají optické senzory, tak je tento způsob jen minimálně invazivní.
Další možností je využití kontaktních čoček obsahujících senzorové molekuly založené na boronových kyselinách k detekci koncentrace glukózy v oční tekutině.[34]
Odkazy
Externí odkazy
Reference
V tomto článku byl použit překlad textu z článku Boronic acid na anglické Wikipedii.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.b00714. (anglicky) DOI: 10.1351/goldbook.
- ↑ C. W. Garner. Boronic acid inhibitors of porcine pancreatic lipase. The Journal of Biological Chemistry. 1980-06-10, s. 5064–5068. ISSN 0021-9258. DOI 10.1016/S0021-9258(19)70749-2. PMID 7372625.
- ↑ R. N. Lindquist; C. Terry. Inhibition of subtilisin by boronic acids, potential analogs of tetrahedral reaction intermediates. Archives of Biochemistry and Biophysics. 1974, s. 135–144. ISSN 0003-9861. DOI 10.1016/s0003-9861(74)80018-4. PMID 4364061.
- ↑ Todd Holyoak; Mark A. Wilson; Timothy D. Fenn; Charles A. Kettner; Gregory A. Petsko; Robert S. Fuller; Dagmar Ringe. 2.4 A resolution crystal structure of the prototypical hormone-processing protease Kex2 in complex with an Ala-Lys-Arg boronic acid inhibitor. Biochemistry. 2003-06-10, s. 6709–6718. ISSN 0006-2960. DOI 10.1021/bi034434t. PMID 12779325.
- ↑ Tobias J. Zimmermann; Marco Bürger; Etsu Tashiro; Yasumitsu Kondoh; Nancy E. Martinez; Kristina Görmer; Sigrid Rosin-Steiner. Boron-based inhibitors of acyl protein thioesterases 1 and 2. ChemBioChem: A European Journal of Chemical Biology. 2013-01-02, s. 115–122. ISSN 1439-7633. DOI 10.1002/cbic.201200571. PMID 23239555.
- ↑ Marvin M. Hansen; Robert A. Jolly; Ryan J. Linder. Boronic Acids and Derivatives—Probing the Structure–Activity Relationships for Mutagenicity. Organic Process Research & Development. 2015-07-29, s. 1507–1516. ISSN 1083-6160. DOI 10.1021/acs.oprd.5b00150.
- ↑ E. Frankland; B. Duppa. On Boric Ethide. Proceedings of the Royal Society. 1860, s. 568–570. DOI 10.1098/rspl.1859.0112.
- ↑ E. Frankland. On a new series of organic compounds containing boron. Journal of the Chemical Society. 1862, s. 363–381. Dostupné online. DOI 10.1039/JS8621500363. Bibcode 1862RSPT..152..167F.
- ↑ Boronic Acids. Příprava vydání Dennis G. Hall. [s.l.]: Wiley, 1862. ISBN 978-3-527-30991-7.
- ↑ KRISTENSEN, Jesper Langgaard; LYSÉN, Morten; VEDSØ, Per; BEGTRUP, Mikael. Synthesis of Ortho Substituted Arylboronic Esters by in situ Traping of Unstable Lithio Intermediates: 2-(5,5-Dimethyl-1,3,2-dioxaborinan-2-yl)benzoic acid ethyl ester. Org. Synth.. 2005, s. 134. Dostupné online.; Coll. Vol.. S. 1015.
- ↑ LI, Wenjie; NELSON, Dorian P.; JENSEN, Mark S.; SCOTT HOERRNER, R.; CAI, Dongwei; LARSEN, Robert D. Synthesis of 3-Pyridylboronic Acid and its Pinacol Ester. Application of 3-Pyridylboronic acid in Suzuki Coupling to Prepare 3-Pyridin-3-ylquinoline. Org. Synth.. 2005, s. 89. Dostupné online.; Coll. Vol.. S. 393.
- ↑ CHARETTE, André B.; LEBEL, Hélène. (2S,3S)-(+)-(3-Phenylcyclopropyl)methanol. Org. Synth.. 1999, s. 86. Dostupné online.; Coll. Vol.. S. 613.
- ↑ WASHBURN, Robert M.; LEVENS, Ernest; ALBRIGHT, Charles F.; BILLIG, Franklin A. Benzeneboronic anhydride. Org. Synth.. 1959, s. 3. Dostupné online.; Coll. Vol.. S. 68.
- ↑ Lukasz T. Pilarski; Kálmán J. Szabó. Palladium-Catalyzed Direct Synthesis of Organoboronic Acids. Angewandte Chemie International Edition. 2011, s. 8230–8232. DOI 10.1002/anie.201102384. PMID 21721088.
- ↑ Gary A. Molander; Sarah L. J. Trice; Spencer D. Dreher. Palladium-Catalyzed, Direct Boronic Acid Synthesis from Aryl Chlorides: A Simplified Route to Diverse Boronate Ester Derivatives. Journal of the American Chemical Society. 2010, s. 17701–17703. DOI 10.1021/ja1089759. PMID 21105666.
- ↑ Tatsuo Ishiyama; Miki Murata; Norio Miyaura. Palladium(0)-Catalyzed Cross-Coupling Reaction of Alkoxydiboron with Haloarenes: A Direct Procedure for Arylboronic Esters. The Journal of Organic Chemistry. 1995-11-01, s. 7508–7510. DOI 10.1021/jo00128a024.
- ↑ WASHBURN, Robert M.; LEVENS, Ernest; ALBRIGHT, Charles F.; BILLIG, Franklin A. Benzeneboronic anhydride. Org. Synth.. 1959, s. 3. Dostupné online.; Coll. Vol.. S. 68.
- ↑ CHAN, Dominic M. T. Copper promoted C–N and C–O bond cross-coupling with phenyl and pyridylboronates. Tetrahedron Letters. 2003, s. 3863–3865. DOI 10.1016/S0040-4039(03)00739-1.
- ↑ LAM, Patrick Y. S. Copper-promoted/catalyzed C–N and C–O bond cross-coupling with vinylboronic acid and its utilities. Tetrahedron Letters. 2003, s. 4927–4931. DOI 10.1016/S0040-4039(03)01037-2.
- ↑ SIEBER, Joshua D. Catalytic Conjugate Addition of Allyl Groups to Styryl-Activated Enones. Journal of the American Chemical Society. 2007, s. 2214–2215. DOI 10.1021/ja067878w. PMID 17266312.
- ↑ GABRIELA. Benzylic Substitution of Gramines with Boronic Acids and Rhodium or Iridium Catalysts †. Organic Letters. 2007, s. 961–964. DOI 10.1021/ol063042m. PMID 17305348.
- ↑ MATTESON, Donald S. 99% Chirally selective synthesis via pinanediol boronic esters: insect pheromones, diols, and an amino alcohol. Journal of the American Chemical Society. 1986, s. 810–819. DOI 10.1021/ja00264a039.
- ↑ PENG, Feng. Simple, Stable, and Versatile Double-Allylation Reagents for the Stereoselective Preparation of Skeletally Diverse Compounds. Journal of the American Chemical Society. 2007, s. 3070–3071. DOI 10.1021/ja068985t. PMID 17315879.
- ↑ MATTESON, Donald S. New asymmetric syntheses with boronic esters and fluoroboranes. Pure Appl. Chem.. 2003, s. 1249–1253. Dostupné online. DOI 10.1351/pac200375091249. S2CID 15944330.
- ↑ KIANMEHR, Ebrahim; YAHYAEE, Maryam; TABATABAI, Katayoun. A mild conversion of arylboronic acids and their pinacolyl boronate esters into phenols using hydroxylamine. Tetrahedron Letters. 2007, s. 2713–2715. DOI 10.1016/j.tetlet.2007.02.069.
- ↑ ISHIYAMA, Tatsuo; MURATA, Miki; AHIKO, Taka-aki; MIYAURA, Norio. Bis(pinacolato)diboron. Org. Synth.. 2000, s. 176. Dostupné online.; Coll. Vol.. S. 115.
- ↑ TAKAGI, Jun. Iridium-catalyzed C–H coupling reaction of heteroaromatic compounds with bis(pinacolato)diboron: regioselective synthesis of heteroarylboronates. Tetrahedron Letters. 2002, s. 5649–5651. DOI 10.1016/S0040-4039(02)01135-8.
- ↑ ISHIYAMA, Tatsuo. Mild Iridium-Catalyzed Borylation of Arenes. High Turnover Numbers, Room Temperature Reactions, and Isolation of a Potential Intermediate. Journal of the American Chemical Society. 2002, s. 390–391. DOI 10.1021/ja0173019. PMID 11792205.
- ↑ ISHIYAMA, Tatsuo. Room temperature borylation of arenes and heteroarenes using stoichiometric amounts of pinacolborane catalyzed by iridium complexes in an inert solvent. Chemical Communications. 2003, s. 2924–5. DOI 10.1039/b311103b. PMID 14680243.
- ↑ MURPHY, Jaclyn M. Meta Halogenation of 1,3-Disubstituted Arenes via Iridium-Catalyzed Arene Borylation. Journal of the American Chemical Society. 2007, s. 15434–15435. DOI 10.1021/ja076498n. PMID 18027947.
- ↑ Jianzhang Zhao; Matthew G. Davidson; Mary F. Mahon; Gabriele Kociok-Köhn; Tony D. James. An Enantioselective Fluorescent Sensor for Sugar Acids. Journal of the American Chemical Society. 2004, s. 16179–16186. DOI 10.1021/ja046289s. PMID 15584754.
- ↑ JAMES, Tony D.; PHILLIPS, Marcus D.; SHINKAI, Seiji. Boronic Acids in Saccharide Recognition. [s.l.]: [s.n.], 2006. ISBN 978-0-85404-537-2. DOI 10.1039/9781847557612.
- ↑ ROWAN, Stuart J.; CANTRILL, Stuart J.; COUSINS, Graham R. L.; SANDERS, Jeremy K. M.; STODDART, J. Fraser. Dynamic Covalent Chemistry. Angewandte Chemie International Edition. 2002, s. 898–952. DOI 10.1002/1521-3773(20020315)41:6<898::AID-ANIE898>3.0.CO;2-E. PMID 12491278.
- ↑ Ocular analyte sensor [online].
Externí odkazy
 Obrázky, zvuky či videa k tématu Boronové kyseliny na Wikimedia Commons
Obrázky, zvuky či videa k tématu Boronové kyseliny na Wikimedia Commons
Média použitá na této stránce
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Meta halogenation Aryl borylation Murphy 2007
Autor: Původně soubor načetl V8rik na projektu Wikipedie v jazyce angličtina, Licence: CC BY-SA 3.0
Boronic Acid Conjugate Addition
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Chan-Lam coupling
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Iridium Arene Borylation Hartwig 2005
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Boronic Acid Gramine Reaction
Autor: Paulyoop, Licence: CC BY-SA 4.0
A general reaction scheme for the protodeboronation of boronic acids
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Boronic ester homologization application
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Boronic ester homologization Mechanism
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Double Allylation reagent based on Boronic ester
Autor: Trebor7, Licence: CC BY-SA 3.0
This image was generated from a crystal structure reported by Jianzhang Zhao, Matthew G. Davidson, Mary F. Mahon, Gabriele Kociok-Köhn, and Tony D. James in J. Am. Chem. Soc., 2004, 126(49), 16179– 6186. DOI: 10.1021/ja046289s. It illustrates L–tartaric acid bound by the diboronic acid based sensor. B-O bonds are highlighted in grey.
Structural formula of a general boronate ester
(c) V8rik at the English Wikipedia, CC BY-SA 3.0
Iridium CHactivation Miyaura Hartwig.