Bromaceton
| Bromaceton | |
|---|---|
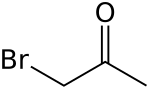 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 1-brompropan-2-on |
| Funkční vzorec | CH2BrC(O)CH3 |
| Sumární vzorec | C3H5BrO |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 598-31-2 |
| PubChem | 11715 |
| ChEBI | 51845 |
| SMILES | BrCC(=O)C |
| InChI | 1/C3H5BrO/c1-3(5)2-4/h2H2,1H3 |
| Vlastnosti | |
| Molární hmotnost | 136,98 g/mol |
| Teplota tání | −36,5 °C (236,6 K) |
| Teplota varu | 137 °C (410 K) |
| Hustota | 1,634 g/cm3 |
| Tlak páry | 1,1 kPa (20 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Bromaceton (systematický název 1-brompropan-2-on) je organická sloučenina se vzorcem CH3C(O)CH2Br. Používá se na přípravu dalších organických látek.
Výskyt
Bromaceton se (v koncentracích pod 1 %) vyskytuje v mořské řase Asparagopsis taxiformis rostoucí v okolí Havajských ostrovů.[2]
Výroba
Bromaceton je komerčně dostupný, často bývá stabilizován oxidem hořečnatým.
Vyrábí se reakcí acetonu s bromem v kyselém prostředí.[3] Aceton se, podobně jako ostatní ketony, za přítomnosti kyseliny či zásady přeměňuje na enol. Na alfa uhlík se následně elektrofilní substitucí naváže brom; přitom může dojít k přebromování, kdy se naváže více atomů bromu, než je potřeba, čímž vznikají dibromované a tribromované produkty. V zásaditém prostředí se tvoří bromoform, jelikož dojde k haloformové reakci.[4]
Použití
Bromaceton se v první světové válce používal jako chemická zbraň. V organické syntéze se používá například na přípravu hydroxyacetonu.[5]
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Bromaceton na Wikimedia Commons
Obrázky, zvuky či videa k tématu Bromaceton na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Bromoacetone na anglické Wikipedii.
- ↑ a b Bromoacetone. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ B. J. Burreson; R. E. Moore; P. P. Roller. Volatile halogen compounds in the alga Asparagopsis taxiformis (Rhodophyta). Journal of Agricultural and Food Chemistry. 1976, s. 856–861.
- ↑ LEVENE, P. A. Bromoacetone. Org. Synth.. 1930, s. 12. Dostupné online. (anglicky); Coll. Vol.. S. 88. (anglicky)
- ↑ W. Reusch. Virtual Textbook of Organic Chemistry [online]. Michigan State University, 5.5. 2013 [cit. 2007-10-27]. Kapitola Carbonyl Reactivity. Dostupné v archivu pořízeném z originálu dne 21.6. 2010.
- ↑ LEVENE, P. A.; WALTI, A. Acetol. Org. Synth.. 1930, s. 1. Dostupné online. (anglicky); Coll. Vol.. S. 5. (anglicky)
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the bromoacetone molecule, a compound used in tear gas.
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Oxygen, O: red
- Bromine, Br: red-brown
bromoacetone







