Brombenzen
| Brombenzen | |
|---|---|
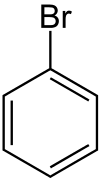 Systematický vzorec | |
 Trojrozměrný vzorec | |
| Obecné | |
| Systematický název | brombenzen |
| Ostatní názvy | monobrombenzen, benzenbromid |
| Anglický název | Bromobenzene |
| Sumární vzorec | C6H5Br |
| Vzhled | Čirá, slabě žlutá kapalina Příjemné aromatickou vůní |
| Identifikace | |
| Registrační číslo CAS | 108-86-1 |
| PubChem | CY9000000 |
| Vlastnosti | |
| Molární hmotnost | 157,01 g/mol |
| Teplota tání | −30,8 °C |
| Teplota varu | 156 °C |
| Hustota | 1,495 g/cm3 |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | R10 R20 R51/53 |
| S-věty | (S2) S24/25 S61 |
| NFPA 704 | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Brombenzen je aromatická sloučenina vzniklá elektrofilní substitucí halogenu, v tomto případě bromu na benzenové jádro za katalýzy Lewisovy kyseliny, jako FeBr3, ZnBr2, a jiné. Má sumární vzorec C6H5Br. Tato bezbarvá až nažloutlá hořlavá kapalina je celkem běžně používaným rozpouštědlem, dále také meziproduktem pro výrobu dalších chemikálií, jako organokovů na bázi lithia, nebo pro syntézu Grignardových činidel.
Použití
Brombenzen se dříve používal při výrobě speciálních insekticidů. Používání látek na bázi bromu jako insekticidů již není aktuální, vzhledem k výrazné toxicitě bromaromátu, kterým tyto insekticidy byly.
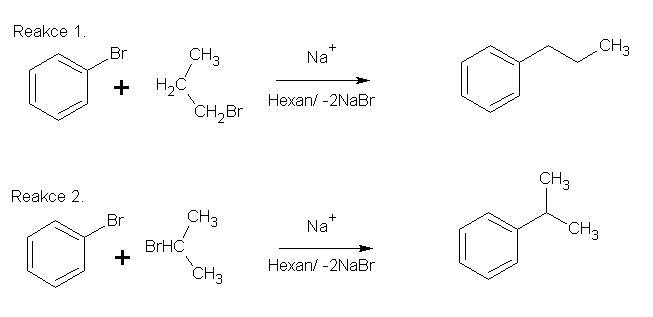
Hojně se využívá k alkylaci, jako například při Wurtz – Fittigově syntéze alkylaromátů. Brombenzen reaguje v bezvodém prostředí se sodíkem a příslušným bromalkanem za vzniku alkylaromátu. Alkyl nahrazuje brom a zavádí alkyl skupinu na jeho místo. Postranní řetězec se váže na místo bromu na benzenu koncovým, případně některým z vnitřních uhlíků, který byl na alkanu substituován bromem. Při použití 1-brompropanu vzniká 1-propylbenzen (viz reakce), pokud použijeme 2-brompropan, vzniká isopropylbenzen (vizreakce 2.), neboli kumen, který se využívá k průmyslové výrobě fenolu a acetonu.
Bezpečnost
Brombenzen poškozuje jaterní a nervový systém. Při vdechnutí může způsobovat edém plic. Brombenzen se také vstřebává pokožkou stejně dobře jako sliznicemi, je to silně dráždivá látka.
Reference
- ↑ a b Bromobenzene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Brombenzen na Wikimedia Commons
Obrázky, zvuky či videa k tématu Brombenzen na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Structure of bromobenzene