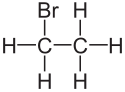
Bromethan
| Bromethan | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | bromethan |
| Ostatní názvy | ethylbromid |
| Funkční vzorec | CH3CH2Br |
| Sumární vzorec | C2H5Br |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 74-96-4 |
| EC-no (EINECS/ELINCS/NLP) | 200-825-5 |
| PubChem | 6332 |
| ChEBI | 47232 |
| SMILES | CCBr |
| InChI | InChI=1S/C2H5Br/c1-2-3/h2H2,1H3 |
| Číslo RTECS | KH6475000 |
| Vlastnosti | |
| Molární hmotnost | 108,97 g/mol |
| Teplota tání | −119 °C (154 K)[1] |
| Teplota varu | 38,4 °C (311,6 K)[1] |
| Hustota | 1,4604 g/cm3 (20 °C)[1] |
| Rozpustnost ve vodě | 0,000 9 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v chloroformu a ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru[1] |
| Tlak páry | 51 kPa (20 °C)[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H302 H332 H351[1] |
| P-věty | P203 P210 P233 P240 P241 P242 P243 P261 P264 P270 P271 P280 P301+317 P303+361+353 P304+340 P317 P318 P330 P370+378 P403+235 P405 P501[1] |
| Teplota vzplanutí | −20 °C (253 K)[1] |
Některá data mohou pocházet z datové položky. | |
Bromethan, také nazývaný ethylbromid, zkráceně EtBr (tato zkratka se také používá pro ethidiumbromid), je organická sloučenina patřící mezi halogenalkany, s etherovým zápachem.
Výroba
Výroba EtBr je vzorem pro další výroby bromalkanů.Obvykle se používá adice bromovodíku (HBr) na ethen:
- H2C=CH2 + HBr → H3C-CH2Br
Bromethan je levný a málokdy se připravuje v laboratoři. Laboratorní přípravu lze provést pomocí ethanolu a směsi kyseliny bromovodíkové a sírové. Dalším možným postupem je refluxování ethanolu s fosforem a bromem; přitom se vytváří bromid fosforitý.[2]
Použití
V organické syntéze se EtBr používá jako syntetický ekvivalent ethylového (Et+) karbokationtu;[3] tento kation se ve skutečnosti nevytváří. Jako příklady mohou sloužit přeměny solí karboxylových kyselin na ethylestery,[4] karboaniontů na ethylaované sloučeniny, thiomočoviny na ethylisothiouroniové soli,[5] a aminů na příslušné ethylaminy.[6]
Bezpečnost
Monohalogenované uhlovodíky s krátkými řetězci jsou, potenciálně nebezpečná, alkylační činidla. Bromidy jsou lepšími alkylačními činidly než chloridy a vystavení těmto látkám by se tak mělo omezovat.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Bromoethane na anglické Wikipedii.
- ↑ a b c d e f g h i j k l https://pubchem.ncbi.nlm.nih.gov/compound/6332
- ↑ OLIVER KAMM; C. S. MARVEL. Alkyl and alkylene bromides. Org. Synth.. 1941. Dostupné online.; Coll. Vol.. S. 25.
- ↑ MAKOSZA, M.; JONCZYK, A. Phase-Transfer Alkylation of Nitriles: 2-Phenylbutyronitrile. Org. Synth.. S. 91. Dostupné online.; Coll. Vol.. S. 897.
- ↑ PETIT, Y.; LARCHEVÊQUE, M. Ethyl Glycidate from (S)-Serine: Ethyl (R)-(+)-2,3-Epoxypropanoate. Org. Synth.. S. 37. Dostupné online.; Coll. Vol.. S. 401.
- ↑ E. BRAND; BRAND, F. C. Guanidodacetic Acid. Org. Synth.. S. 440. Dostupné online.; Coll. Vol..
- ↑ BRASEN, W. R; HAUSER, C. R. o-Methylethylbenzyl Alcohol. Org. Synth.. S. 58. Dostupné online.; Coll. Vol.. S. 582.
Externí odkazy
 Obrázky, zvuky či videa k tématu Bromethan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Bromethan na Wikimedia Commons - Bezpečnostní list
- NIOSH Pocket Guide to Chemical Hazards
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Ball-and-stick model of the bromoethane molecule, a haloalkane and an important source of the ethyl group.
Structure of Bromoethane
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances