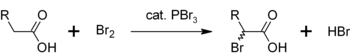Bromid fosforitý
| Bromid fosforitý | |
|---|---|
 Struktura molekuly bromidu fosforitého | |
 Struktura molekuly bromidu fosforitého | |
| Obecné | |
| Systematický název | Bromid fosforitý |
| Anglický název | Phosphorus tribromide |
| Německý název | Phosphortribromid |
| Sumární vzorec | PBr3 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 7789-60-8 |
| EC-no (EINECS/ELINCS/NLP) | 232-178-2 |
| PubChem | 24614 |
| Číslo RTECS | TH4460000 |
| Vlastnosti | |
| Molární hmotnost | 270,686 g/mol |
| Teplota tání | −40,5 °C |
| Teplota varu | 173,2 °C |
| Hustota | 3,412 g/cm3 (−79 °C) 2,871 g/cm3 (20,7 °C) |
| Index lomu | nD= 1,696 32 (27 °C) |
| Rozpustnost ve vodě | reaguje |
| Rozpustnost v polárních rozpouštědlech | diethylether s alkoholy reaguje |
| Rozpustnost v nepolárních rozpouštědlech | chlorid uhličitý aromatické uhlovodíky |
| Součin rozpustnosti | 3,88 (20 °C) |
| Povrchové napětí | 44,7 mN/m (0 °C) 36 mN/m (100 °C) |
| Struktura | |
| Dipólový moment | 2,0×10−30 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −132 kJ/mol (plyn) −177 kJ/mol (kapalina) |
| Entalpie varu ΔHv | 143 J/g |
| Standardní molární entropie S° | 348 JK−1mol−1 (plyn) |
| Standardní slučovací Gibbsova energie ΔGf° | −155,7 kJ/mol (plyn) |
| Izobarické měrné teplo cp | 0,281 JK−1g−1 (25 °C, plyn) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R14, R34, R37 |
| S-věty | (S1/2), S26, S45 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Bromid fosforitý je anorganická sloučenina se vzorcem PBr3, jeden z bromidů fosforu. Za běžných podmínek se jedná o bezbarvou kapalinu, která na vzduchu dýmá (protože podléhá hydrolýze vzdušnou vlhkostí) a pronikavě páchne. Široce se používá v laboratořích na přeměny alkoholů na alkylbromidy.
Příprava
PBr3 se připravuje působením bromu na červený fosfor. Fosfor musí být v nadbytku, aby se zabránilo tvorbě PBr5:[2]
Reakce
Bromid fosforitý, podobně jako chlorid a fluorid fosforitý, má vlastnosti jak Lewisovy kyseliny, tak Lewisovy zásady. Například s Lewisovou kyselinou, jako je bromid boritý, tvoří stabilní adukty, kupříkladu Br3B-PBr3. Současně ale může v mnoha reakcích reagovat jako elektrofil či Lewisova kyselina, například s aminy.
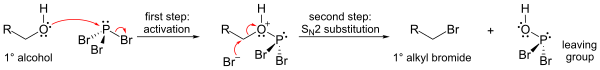
Nejdůležitějšími reakcemi PBr3 jsou ty s alkoholy, kde se hydroxylová skupina nahrazuje atomem bromu a vzniká alkylbromid. Všimněte si, že lze přenést všechny tři atomy bromu.
- PBr3 + 3 ROH → 3 RBr + HP(O)(OH)2
Mechanismus (ukázaný pro primární alkohol) zahrnuje počáteční aktivaci kyslíkového atomu v molekule alkoholu elektrofilním fosforem (čímž vzniká dobrá odstupující skupina) a substituci SN2 na atomu uhlíku.
Vzhledem k substitučnímu kroku SN2 tato reakce obecně dobře funguje pro primární a sekundární alkoholy, ale selhává pro alkoholy terciární. Pokud je reakční uhlíkové centrum chirální, reakce většinou invertuje konfiguraci na alfa uhlíku alkoholu, jak je u reakcí SN2 obvyklé.
Podobnou reakcí PBr3 přeměňuje také karboxylové kyseliny na acylbromidy:
- PBr3 + 3 RCOOH → 3 RCOBr + HP(O)(OH)2
PBr3 je poměrně silným redukčním činidlem, oxidace PBr3 plynným kyslíkem je mnohem bouřlivější než u PCl3. Reakce probíhá explozivně za vzniku oxidu fosforečného a bromu.
Použití
Hlavním použitím bromidu fosforitého je přeměna primárních a sekundárních alkoholů na alkylbromidy,[3] jak je popsáno výše. PBr3 obvykle poskytuje vyšší výtěžnost než kyselina bromovodíková a lze se vyhnout problémům s přesmykem karbokationtu. Například i neopentylbromid lze získat z alkoholu s výtěžností 60 %.[4]
Jinou oblastí použití PBr3 je jako katalyzátor α-bromace karboxylových kyselin. Přestože se acylbromidy vyrábějí v porovnání s acylchloridy v mnohem menší míře, používají se jako meziprodukty v Hell-Volhard-Zelinského halogenaci.[5] Nejdřív PBr3 reaguje s karboxylovou kyselinou za vzniku acylbromidu, který je při bromaci reaktivnější. Celý proces vypadá takto:
Bromid fosforitý se využívá také při výrobě léčiv, například alprazolamu, methohexitalu nebo fenoprofenu. Je též potentním zpomalovačem hoření.
Bezpečnost
PBr3 uvolňuje žíravý bromovodík, je toxický a bouřlivě reaguje s vodou a alkoholy.
V reakcích, kde jako vedlejší produkt vzniká kyselina fosforitá, je při destilaci třeba dát pozor na to, že se tato může při teplotě nad cca 160 °C rozkládat za vzniku fosfanu, který může při kontaktu se vzduchem explodovat.[3]
Reference
V tomto článku byl použit překlad textu z článku Phosphorus tribromide na anglické Wikipedii.
- ↑ a b Phosphorus tribromide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Theodore M. Burton and Ed. F. Degering. The Preparation of Acetyl Bromide. J. Am. Chem. Soc.. 1940, s. 227. doi:10.1021/ja01858a502.
- ↑ a b GEORGE C. HARRISON, H. DIEHL. β-Ethoxyethyl bromide. Org. Synth.. 1955. Dostupné online.; Coll. Vol.. S. 370.
- ↑ L. G. Wade, Jr., Organic Chemistry, 6th ed., p. 477, Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
- ↑ L. G. Wade, Jr., Organic Chemistry, 6th ed., p. 1051, Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- R. R. Holmes. An examination of the basic nature of the trihalides of phosphorus, arsenic and antimony,. Journal of Inorganic and Nuclear Chemistry. 1960, s. 266–275. doi:10.1016/0022-1902(60)80372-7.
Externí odkazy
 Obrázky, zvuky či videa k tématu bromid fosforitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu bromid fosforitý na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Autor: Hbf878, Licence: CC0
Mechanism for the conversion of a primary alcohol to an alkyl bromide using phosphorus tribromide (PBr3).