Bromid hlinitý
| Bromid hlinitý | |
|---|---|
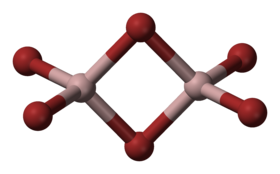 Dimerní molekula bromidu hlinitého | |
| Obecné | |
| Systematický název | Bromid hlinitý |
| Anglický název | Aluminium bromide |
| Německý název | Aluminiumbromid |
| Sumární vzorec | AlBr3 |
| Vzhled | bílá hygroskopická práškovitá nebo krystalická pevná látka |
| Identifikace | |
| Registrační číslo CAS | 7727-15-3 |
| 7784-27-2 (hexahydrát) | |
| EC-no (EINECS/ELINCS/NLP) | 231-779-7 |
| PubChem | 24409 |
| UN kód | 1725 |
| SMILES | Br[Al](Br)Br |
| InChI | 1S/Al.3BrH/h;3*1H/q+3;;;/p-3 |
| Číslo RTECS | BD0350000 |
| Vlastnosti | |
| Molární hmotnost | 266,693 g/mol |
| Teplota tání | 97,1 °C |
| Teplota varu | 255 °C |
| Hustota | 3,205 g/cm3 (18 °C) |
| Rozpustnost ve vodě | reaguje |
| Rozpustnost v polárních rozpouštědlech | alkoholy (reaguje) diethylether aceton |
| Rozpustnost v nepolárních rozpouštědlech | tetrachlormethan sirouhlík kapalné uhlovodíky |
| Struktura | |
| Krystalová struktura | šesterečná |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −513,4 kJ/mol |
| Entalpie tání ΔHt | 42,2 J/g |
| Entalpie varu ΔHv | 188 J/g |
| Standardní molární entropie S° | 180,2 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −490,6 kJ/mol |
| Izobarické měrné teplo cp | 0,377 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| NFPA 704 | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Bromid hlinitý (AlBr3) je chemická sloučenina, patří mezi halogenidy. Nejobvyklejší formou je dimer (Al2Br6), který je za normálních podmínek hygroskopická krystalická pevná látka.
Je mírně toxický, LD50 je 1 598 mg/kg.
Výroba
Bromid hlinitý se vyrábí několika způsoby, například:
6/n "[AlBr]n" → Al2Br6 + 4 Al nebo
2 Al + 6 HBr → Al2Br6 + 3 H2, také přímou reakcí hliníku s bromem:
2 Al + 3 Br2 → Al2Br6.
Reakce
Bromid hlinitý reaguje s tetrachlormethanem při teplotě asi 100 °C, přitom vzniká tetrabrommethan:
4 AlBr3 + 3 CCl4 → 4 AlCl3 + 3 CBr4.
S fosgenem reaguje za vzniku karbonylbromidu a chlorobromidu hlinitého:
AlBr3 + COCl2 → COBr2 + AlCl2Br.
Použití
Bezvodá forma se používá jako katalyzátor při Friedel-Craftově alkylaci (používá se i bezvodý chlorid hlinitý).
Reference
V tomto článku byl použit překlad textu z článku Aluminium bromide na anglické Wikipedii.
- ↑ a b Aluminum bromide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu bromid hlinitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu bromid hlinitý na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Autor: Petrovskyz, Licence: CC BY-SA 4.0
A demonstration of the reaction of the product Al2Br6 with water. This is a very vigorous (exoenergetic) reaction, the product of which is an aqueous solution of aluminum bromide. This is also a neutralisation reaction between strong Lewis acid (Al2Br6) and strong Lewis base (H2O). The product is, as are most salts in aqueous solution, completely dissociated:
- Al2Br6(Br2) + 12H2O(l) = 2[Al(H2O)6]3+(aq) + 6Br–(aq).
Autor: Petrovskyz, Licence: CC BY-SA 4.0
Experiment showing direct synthesis of aluminum bromide from the elementary substances. The reaction is very vigorous and can be presented by the equation:
- 2Al(s) + 3Br2(l) = Al2Br6(Br2).
The product, as indicated by the equation, is dissolved in the excess bromine.
Planned and performed by Marina Stojanovska, Miha Bukleski and Vladimir Petruševski, Department of Chemistry, FNSM, Ss. Cyril and Methodius University, Skopje, Macedonia.Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
chemical strucuture of the aluminium bromide dimer










