Bromid nikelnatý
| Bromid nikelnatý | |
|---|---|
 Struktura | |
 Vzorek bromidu nikelnatého | |
| Obecné | |
| Systematický název | bromid nikelnatý |
| Sumární vzorec | NiBr2 |
| Vzhled | hnědožlutá pevná látka (bezvodý) modrozelená pevná látka (hexahydrát) |
| Identifikace | |
| Registrační číslo CAS | 13462-88-9 |
| EC-no (EINECS/ELINCS/NLP) | 236-665-0 |
| PubChem | 278492 |
| SMILES | [Ni](Br)Br |
| InChI | InChI=1S/2BrH.Ni/h2*1H;/q;;+2/p-2 |
| Vlastnosti | |
| Molární hmotnost | 218,50 g/mol |
| Teplota sublimace | 963 °C (1236 K) |
| Hustota | 5,098 g/cm3[1] |
| Rozpustnost ve vodě | 134 g/100 ml |
| Bezpečnost | |
| [2] | |
| H-věty | H317 H334 H341 H350 H360 H372 H400 H410[2] |
| P-věty | P203 P260 P261 P264 P270 P272 P273 P280 P281 P284 P302+352 P304+340 P318 P319 P321 P333+313 P342+316 P362+364 P391 P405 P501[2] |
Některá data mohou pocházet z datové položky. | |
Bromid nikelnatý je označení pro anorganické sloučeniny odpovídající vzorci NiBr2(H2O)x; hodnota x může být 0 u bezvodé soli, nebo 2, 3, či 6 u hydrátů. Bezvodý NiBr2 je hnědožlutý a rozpouští se ve vodě za vzniku modrozeleného hexahydrátu.
Struktura
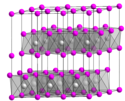
Struktura bromidu nikelnatého závisí na míře hydratace. V pevných formách zaujímají nikelnaté ionty oktaedrickou geometrii. Podobné struktury byly pozorovány i u vodných roztoků.[3]
- Bezvodý NiBr2 má strukturu chloridu kademnatého.[4] Délky vazeb Ni-Br jsou 252—258 pm.[3]
- Struktura trihydrátu je pravděpodobně řetězovitá.[5]
- Dihydrát a hexahydrát mají struktury podobné jako odpovídající chloridy. Dihydrát se skládá z lineárních řetězců, zatímco hexahydrát obsahuje oddělené molekuly trans-[NiBr2(H2O)4] se dvěma molekulami krystalové vody.
Reakce a použití
NiBr2 se chová jako Lewisova kyselina, což se projevuje vznikem hydrátů i tvorbou aduktů při reakcích s Lewisovými zásadami.
NiBr2 lze použít na přípravu katalyzátorů křížových párování a karbonylací.[4] NiBr2-glym má při některých přeměnách vyšší aktivitu než NiCl2-glym.[6]

Bezpečnost
Bromid nikelnatý je podezřelý z karcinogenních účinků.[7]
Reference
V tomto článku byl použit překlad textu z článku Nickel(II) bromide na anglické Wikipedii.
- ↑ Archived copy [online]. [cit. 2008-05-07]. Dostupné v archivu pořízeném z originálu dne 2007-10-07.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/278492
- ↑ a b Hisanobu Wakita; Mitsuyoshi Ichihashi; Takeharu Mibuchi; Isao Masuda. The Structure of Nickel(II) Bromide in Highly Concentrated Aqueous Solution by X-Ray Diffraction Analysis. Bulletin of the Chemical Society of Japan. 1982-03-01, s. 817–821. ISSN 0009-2673. doi:10.1246/bcsj.55.817.
- ↑ a b Tien-Yau Luh; Chi-Hong Kuo. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: John Wiley & Sons, 2001. ISBN 9780470842898. doi:10.1002/047084289X.rn009.
- ↑ DeFotis, G. C.; Goodey, J. R.; Narducci, A. A.; Welch, M. H. "NiBr2·3H2O, a lower dimensional antiferromagnet" Journal of Applied Physics (1996), 79(8, Pt. 2A), 4718-4720. doi:10.1063/1.361651
- ↑ Mikhail O. Konev; Luke E. Hanna; Elizabeth R. Jarvo. Intra- and Intermolecular Nickel-Catalyzed Reductive Cross-Electrophile Coupling Reactions of Benzylic Esters with Aryl Halides. Angewandte Chemie International Edition. 2016, s. 6730–6733. doi:10.1002/anie.201601206. PMID 27099968.
- ↑ NICKEL BROMIDE | CAMEO Chemicals | [online]. NOAA. Dostupné online.
Externí odkazy
 Obrázky, zvuky či videa k tématu Bromid nikelnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Bromid nikelnatý na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Autor: Orci, Licence: CC BY-SA 3.0
crystal structure of en:cadmium iodide
Bromid nikelnatý