Bromid titaničitý
| Bromid titaničitý | |
|---|---|
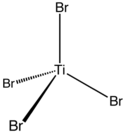
 Strukturní vzorec bromidu titaničitého | |
 Kuličkový model bromidu titaničitého | |
| Obecné | |
| Systematický název | Bromid titaničitý |
| Anglický název | Titanium tetrabromide |
| Německý název | Titan(IV)-bromid |
| Sumární vzorec | TiBr4 |
| Vzhled | oranžovo-hnědé krystaly |
| Identifikace | |
| Registrační číslo CAS | 7789-68-6 |
| SMILES | [Ti](Br)(Br)(Br)Br |
| InChI | 1S/4BrH.Ti/h4*1H;/q;;;;+4/p-4 |
| Vlastnosti | |
| Molární hmotnost | 367,483 g/mol |
| Teplota tání | 39 °C |
| Teplota varu | 230 °C |
| Hustota | 3,25 g.cm−3 |
| Rozpustnost ve vodě | hydrolyzuje |
Některá data mohou pocházet z datové položky. | |
Bromid titaničitý, TiBr4, je oranžová až hnědá krystalická látka.[1] Jde o nejtěkavější bromid přechodného kovu. Jeho vlastnosti se pohybují mezi chloridem a jodidem titaničitým. Je diamagnetický, což odpovídá d0 konfiguraci titaničitého kationtu.
Příprava a struktura
Lze ho připravit několika metodami, přímou reakcí z prvků, bromací oxidu v přítomnosti uhlíku (analogie Krollova procesu) nebo bromací chloridu titaničitého:
- Ti + 2 Br2 → TiBr4
- TiO2 + 2 C + 2 Br2 → TiBr4 + 2 CO
- 3 TiCl4 + 4 BBr3 → 3 TiBr4 + 4 BCl3
- TiO2 + 2 C + 2 Br2 → TiBr4 + 2 CO
Má tetraedrickou geometrii.[1]
Reakce
Vytváří adukty typu TiBr4(THF)2 a [TiBr5]−.[2] S objemnými ligandy, např. 2-methylpyridinem, vytváří pětikoordinované adukty. TiBr4(2-MePy) má tvar trigonální bipyramidy, pyridinový ligand je v ekvatoriální rovině.[3]
Využívá se jako Lewisova kyselina v organické syntéze.[4]
Bromid a chlorid titaničitý spolu reagují za vzniku směsi halogenidů TiBr4−xClx (x = 0–4). Přesný mechanismus reakce není znám, ale pravděpodobně dochází ke vzniku dimerního meziproduktu.[5]
Bezpečnost
Bromid titaničitý reaguje prudce s vodou za vývoje bromovodíku.[6]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Titanium tetrabromide na anglické Wikipedii.
- ↑ a b GREENWOOD, Norman Neill. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. Dostupné online. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. OCLC 320245801 S. 1190–1191.
- ↑ CREASER, Colin S.; CREIGHTON, J. Alan. Pentachloro- and pentabromo-titanate(IV) ions. Journal of the Chemical Society, Dalton Transactions. 1975, čís. 14, s. 1402. Dostupné online [cit. 2022-12-15]. ISSN 0300-9246. DOI 10.1039/dt9750001402. (anglicky)
- ↑ HENSEN, Karl; LEMKE, Alexander; BOLTE, Michael. Tetrabromo(2-methylpyridine- N )titanate(IV). Acta Crystallographica Section C Crystal Structure Communications. 2000-12-15, roč. 56, čís. 12, s. e565–e566. Dostupné online [cit. 2022-12-15]. ISSN 0108-2701. DOI 10.1107/S0108270100015407.
- ↑ PATTERSON, Brian; MARUMOTO, Shinji; RYCHNOVSKY, Scott D. Titanium(IV)-Promoted Mukaiyama Aldol−Prins Cyclizations. Organic Letters. 2003-08-01, roč. 5, čís. 17, s. 3163–3166. Dostupné online [cit. 2022-12-15]. ISSN 1523-7060. DOI 10.1021/ol035303n. (anglicky)
- ↑ WEBB, Simon P.; GORDON, Mark S. Intermolecular Self-Interactions of the Titanium Tetrahalides TiX 4 (X = F, Cl, Br). Journal of the American Chemical Society. 1999-03-01, roč. 121, čís. 11, s. 2552–2560. Dostupné online [cit. 2022-12-15]. ISSN 0002-7863. DOI 10.1021/ja983339i. (anglicky)
- ↑ (anglicky)Material Safety Data Sheet
Externí odkazy
 Obrázky, zvuky či videa k tématu Bromid titaničitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Bromid titaničitý na Wikimedia Commons
Média použitá na této stránce
Ball-and-stick model of the titanium tetrabromide molecule
structure of titanium tetrabromide