Butan
| Butan | |
|---|---|
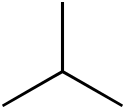
Racionální vzorec n-butanu | |
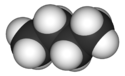
 3D model molekuly n-butanu | |
| Obecné | |
| Systematický název | butan |
| Triviální název | n-butan |
| Anglický název | n-Butane |
| Německý název | n-Butan |
| Funkční vzorec | H3C-CH2-CH2-CH3 |
| Sumární vzorec | C4H10 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 106-97-8 |
| EC-no (EINECS/ELINCS/NLP) | 203-448-7 |
| Indexové číslo | 601-004-00-0 |
| PubChem | 7843 |
| UN kód | 1011 1075 (LPG) |
| SMILES | CCCC |
| Vlastnosti | |
| Molární hmotnost | 58,123 g/mol |
| Teplota tání | −138,4 °C (134,75 K) |
| Teplota varu | −0,5 °C (272,65 K) |
| Hustota | 2,48 kg/m3 (plyn, 15 °C) 600 kg/m3 (kapalina, 0 °C, 101,3 kPa) |
| Rozpustnost ve vodě | 6,1 mg/100 ml (20 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H220 |
| R-věty | R12 |
| S-věty | (S2) S9 S16 |
| NFPA 704 | |
| Teplota vznícení | 500 °C |
Některá data mohou pocházet z datové položky. | |
Název butan se používá jako:
- systematický název pro nerozvětvený alkan se čtyřmi atomy uhlíku v molekule, (funkční vzorec CH3CH2CH2CH3), triviálním názvem n-butan
- společný název pro izomery alkanu se sumárním vzorcem C4H10; jsou dva a to n-butan a isobutan (triviální název), systematicky methylpropan (vzorec CH(CH3)3)
- označení směsi obou izomerů butanu
Tento článek je o obou izomerech butanu; infobox pak obsahuje informace pouze o nevětveném butanu; podrobnosti o isobutanu jsou uvedeny samostatně.
Oba butany jsou velmi hořlavé, bezbarvé, snadno zkapalnitelné plyny bez zápachu. Název butan je složen z částí but- podle acidum butyricum – latinského názvu pro kyselinu máselnou, karboxylovou kyselinu se stejným počtem atomů uhlíku v molekule a -an, přípony označující alkany.
Rotace okolo centrální chemické vazby C-C tvoří dvě konformace (trans a gauche)[2].
Reakce
Při dostatku kyslíku se butan spaluje na oxid uhličitý a vodní páru. Při nedostatku kyslíku může vznikat také uhlík (saze) a oxid uhelnatý.
- 2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
n-butan je surovinou v DuPontově katalytickém procesu přípravy maleinanhydridu:
- 2 H3C-CH2-CH2-CH3 + 7 O2 → 2 C2H2(CO)2O + 8 H2O
n-butan, podobně jako všechny uhlovodíky, podléhá chloraci volnými radikály, kdy vznikají 1-chlor- a 2-chlorbutan, a dále i deriváty s vyšším počtem atomů chloru. Různá relativní míra chlorace je částečně vysvětlena odlišnými vazebnými disociačními energiemi, 425 a 411 kJ/mol u dvou typů C-H vazeb. Dva centrální atomy uhlíku mají mírně slabší vazby C-H.
- Struktura izomerů butanu
- n-butan
- isobutan
Použití

Butan se prodává v láhvích jako palivo pro vařiče a podobné účely. Směs butanu s propanem (a dalšími uhlovodíky) se komerčně nazývá propan-butan. Pro použití ve formě motorového paliva se však tato propan-butanová směs prodává pod zkratkou LPG.[3]
Butan je kromě toho v určité míře i složkou benzinu, surovinou pro výrobu základních petrochemikálií při parním krakování, používá se jako palivo v cigaretových zapalovačích a jako hnací plyn ve sprejích.
Velmi čisté formy, zvláště isobutanu, lze používat jako chladivo a ve značné míře tedy nahrazují halomethany nebezpečné pro ozónovou vrstvu, například v domácích chladničkách a mrazničkách. Hořlavost butanu není příliš velkým problémem, protože množství obsažené v zařízení není tak velké, aby vytvořilo výbušnou směs se vzduchem v místnosti. Operační tlak butanu je nižší než u halomethanů, například R-12, proto systémy s tímto plynem (např. automobilové klimatizace) nebudou při použití butanu fungovat optimálně.

Účinky na zdraví
Butan je prostý asfyxant a jeho toxické účinky jsou dány vytlačováním kyslíku. Nemá žádné přímé systémové účinky[4]. Inhalace butanu může způsobit euforii, ospalost, narkózu, asfyxii, srdeční arytmii a omrzliny. Může dojít i k smrti způsobené asfyxií a fibrilací komor.
Butan je nejčastěji zneužívanou těkavou látkou ve Velké Británii a v roce 2000 způsobil 52 % úmrtí „spjatých s rozpouštědly“[5]. Při vstřikování butanu přímo do krku se kapalina expanzí rychle ochlazuje na –20 °C a může způsobit prodloužený laryngospasmus[6]. Syndrom „náhlé čichačovy smrti“ (SSD), poprvé popsaný Bassem v roce 1970[7], je nejčastější prostou příčinou smrtí spjatých s rozpouštědly, tvoří 55 % známých smrtelných případů[6].
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Butane na anglické Wikipedii.
- ↑ a b Butane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Roman M. Balabin. Enthalpy Difference between Conformations of Normal Alkanes: Raman Spectroscopy Study of n-Pentane and n-Butane. J. Phys. Chem. A. 2009, roč. 113, čís. 6, s. 1012. doi:10.1021/jp809639s.
- ↑ Základní informace o LPG a o jízdě na zkapalněný ropný plyn
- ↑ Butane - International Programme on Chemical Safety - Poisons Information Monograph 945. www.inchem.org [online]. [cit. 2009-08-21]. Dostupné v archivu pořízeném dne 2014-03-14.
- ↑ Trends in death Associated with Abuse of Volatile Substances 1971-2004 Archivováno 27. 3. 2007 na Wayback Machine. Field-Smith M, Bland JM, Taylor JC, et al., Department of Public Health Sciences. London: St George’s Medical School
- ↑ a b Ramsey J, Anderson HR, Bloor K, et al. An introduction to the practice, prevalence and chemical toxicology of volatile substance abuse. Hum Toxicol 1989;8:261–9
- ↑ Bass M. Sudden sniffing death. JAMA 1970;212:2075–9
Externí odkazy
 Obrázky, zvuky či videa k tématu butan na Wikimedia Commons
Obrázky, zvuky či videa k tématu butan na Wikimedia Commons  Galerie butan na Wikimedia Commons
Galerie butan na Wikimedia Commons Slovníkové heslo butan ve Wikislovníku
Slovníkové heslo butan ve Wikislovníku- ŠlápniNaPlyn.cz – portál o vozidlech s pohonem na LPG, CNG a bioplyn
- International Chemical Safety Card 0232
- NIOSH Pocket Guide to Chemical Hazards
- n-Butane Molecule of the Month
- Computational Chemistry Wiki
- World LP Gas Association (WLPGA)
- UKLPG Propane and Butane in the UK
- Global BioSciences In-Situ Bioremediation utilizing Butane
- Butane Viscosity as function of temperature and pressure
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Autor: Sun Ladder, Licence: CC BY-SA 3.0
Butane gas cylinder on white background
isobutan (i-nutane) skeletal
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.