Metoda CRISPR

Editace genu CRISPR je technika genetického inženýrství v molekulární biologii, kterou lze modifikovat genomy živých organismů. Je založen na zjednodušené verzi bakteriální CRISPR - Cas9 antivirovém obranném systému. Dodáním nukleasy Cas9 spojenou se syntetickou vodicí RNA (gRNA) do buňky je možné genom buňky štěpit na požadovaném místě, což umožňuje odstranit stávající geny a / nebo přidat nové geny in vivo.
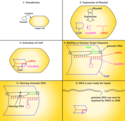
Nukleáza Cas9, která pracuje jako genetické nůžky, otevírá oba řetězce cílové sekvence DNA a zavádí modifikaci jedním ze dvou způsobů. Knock-in mutace, usnadněné prostřednictvím homologie řízené opravy (HDR), je tradiční cestou cílených genomických editačních přístupů. To umožňuje zavedení cíleného poškození a opravy DNA . HDR využívá použití podobných sekvencí DNA k řízení opravy zlomů začleněním exogenní DNA, aby fungovala jako templát opravy. Tato metoda se spoléhá na periodický a izolovaný výskyt poškození DNA v cílovém místě, aby mohla být zahájena oprava. Knock-out mutace způsobené CRISPR-Cas9 mají za následek opravu dvojvláknového zlomu pomocí nehomologního spojení konců (NHEJ). NHEJ může často vést k náhodným delecím nebo inzercím v místě opravy, což může narušit nebo změnit funkčnost genu. Proto genomové inženýrství CRISPR-Cas9 dává vědcům možnost vytvářet cílené náhodné změny v genu. Z tohoto důvodu je přesnost úpravy genomu velkým problémem. Genomická editace vede k nevratným změnám genomu.
Techniky úpravy genomu CRISPR-Cas9 mají mnoho potenciálních aplikací, včetně medicíny a zemědělství. Využití komplexu CRISPR-Cas9-gRNA pro editaci genomu bylo pro průlom roku v roce 2015 volbou AAAS.[1] Mnoho bioetických otázek je spojeno s možností použití CRISPR pro úpravu zárodečných linií, zejména u lidských embryí.
Tato technika je považována za vysoce významnou v biotechnologii a medicíně, protože umožňuje editaci genomů „in vivo“ s extrémně vysokou přesností, levně a snadno. V roce 2020 obdržely autorky této metody Jennifer Doudnaová a Emmanuelle Charpentierová Nobelovu cenu za chemii.[2] Zásadní podíl na objevu má také Čech Martin Jínek, který dříve pracoval v týmu Jennifer Doudnaové v Berkeley.[3]
Předchůdci
Na začátku roku 2000 vědci vyvinuli zinc finger nukleázy (ZFNs), syntetické proteiny, jejichž DNA-vazebné domény jim umožňují vytvářet dvojřetezcové zlomy DNA v určitých místech. V roce 2010 syntetické nukleasy nazývané efektorové nukleázy podobné transkripčním aktivátorům (TALENs) poskytly snadnější způsob, jak zacílit dvouvláknové přerušení na konkrétním místě na řetězci DNA. Zinc finger nukleázy i TALEN vyžadují design a vytvoření vlastního proteinu pro každou cílenou sekvenci DNA, což je mnohem obtížnější a časově náročnější proces než navrhování naváděcích RNA. Design CRISPR je mnohem snazší navrhnout, protože proces vyžaduje syntézu pouze krátké sekvence RNA, což je postup, který je již široce používán pro mnoho dalších technik v molekulární biologii (např. Vytváření oligonukleotidových primerů).
Genomové inženýrství

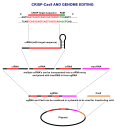
Úprava genomu CRISPR-Cas9 se provádí pomocí systému CRISPR typu II. Pro editaci genomu, zahrnuje tento systém Cas9, crRNA a tracrRNA spolu s templátem pro opravu DNA, která se používá buď v nehomologním spojování koncových bodů (NHEJ), nebo při homologicky řízené opravě (HDR).

| Komponent | Funkce |
|---|---|
| crRNA | Obsahuje vodící RNA, která lokalizuje správný segment hostitelské DNA spolu s oblastí, která se váže na tracrRNA (obvykle ve formě vlásenky se smyčkou ) a vytváří aktivní komplex. |
| tracrRNA | Se váže na crRNA a tvoří aktivní komplex. |
| sgRNA | Jednovidové RNA jsou kombinované RNA sestávající z tracrRNA a alespoň jedné crRNA. |
| Cas9 | Nukleáza, štěpicí DNA. |
| Oprava šablony | Vložení specifického templátu DNA do místa zlomu vytvořeného Cas9 nukleázou. |
CRISPR-Cas9 často používá plazmid k transfekci cílových buněk. Hlavní složky tohoto plazmidu jsou zobrazeny na obrázku a uvedeny v tabulce. CrRNA je unikatně a specificky navržena pro každou aplikaci, protože jde o sekvenci, kterou Cas9 používá k identifikaci a přímé vazbě na specifické sekvence v DNA hostitelské buňky.
crRNA a tracrRNA mohou být spojeny dohromady, aby vytvořily jednovidkovou RNA (sgRNA).[4] Tato sgRNA může být vnesena do buňky spolu s genem kódujícím protein Cas9. K dispozici je mnoho online nástrojů, které slouží k navrhování sekvenci sgRNA.

CRISPR-Cas9 má poměrně jednoduchou konstrukci. Jeho specificita závisí na dvou faktorech: cílové sekvenci a sekvenci PAM. Cas9-nukleáza vybírá správné umístění v genomu hostitele pomocí PAM. Sekvence není součástí proteinu Cas9 a jako výsledek je přizpůsobitelná a může být nezávisle syntetizována. Cas9 nelze snadno modifikovat tak, aby rozpoznával jinou sekvenci PAM. To však v konečném důsledku není příliš omezující, protože je to obvykle velmi krátká a nespecifická sekvence, která se vyskytuje často na mnoha místech v celém genomu (např. Sekvence PAM SpCas9 je 5'-NGG-3 'a v lidském genomu se vyskytuje zhruba každých 8 až 12 párů bází).
Jakmile jsou tyto sekvence sestaveny do plazmidu a transfekovány do buněk, protein Cas9 pomocí sgRNA najde správnou sekvenci v DNA hostitelské buňce a - v závislosti na variantě Cas9 - vytvoří jednovláknový nebo dvouřetězcový zlom.
Správně rozmístěné jednovláknové zlomy v hostitelské DNA mohou vyvolat homologicky řízenou opravu (HDR), která je méně náchylná k chybám než nehomologní spojení konců (NHEJ), které obvykle následuje po dvouvláknovém zlomu. Poskytnutí opravy DNA šablony umožňuje vložení specifické sekvence DNA na přesném místě v genomu. Cílem je, aby nativní proces HDR buňky využíval poskytovanou opravnou šablonu a tím začlenil novou sekvenci do genomu. Jakmile je tato nová sekvence začleněna, je nyní součástí genetického materiálu buňky a přechází do jejích dceřiných buněk.
Dodání Cas9, sgRNA a přidružených komplexů do buněk může nastat prostřednictvím virových a nevirových systémů. Elektroporace DNA, RNA nebo ribonukleokomplexů je běžnou technikou, i když může mít za následek škodlivé účinky na cílové buňky. Techniky chemické transfekce využívající lipidy byly také použity k zavedení sgRNA v komplexu s Cas9 do buněk. Typy buněk, které jsou obtížněji transfekovatelné (např. Kmenové buňky, neurony a hematopoetické buňky), vyžadují účinnější dodávací systémy, jako jsou například systémy založené na lentiviru (LV), adenoviru (AdV) a adeno-asociovaném viru (AAV).[5]
Teoretické využití CRISPR-Cas9 v léčbě AIDS
AIDS je závažné onemocnění způsobené retrovirem HIV. Aktuálně dostupná léčiva fungují na principu inhibice různých kroků životního cyklu retroviru, tzn. zabraňují například správnému fungování reverzní transkriptázy či vstupu nově vytvořených virových částic do dalších buněk infikovaného hostitele. HIV je integrujícím virem, tzn. je schopen začlenit svou genetickou informaci do genomu hostitele. Jakožto součást hostitelského genomu je jednak chráněna před imunitním systémem, jednak aktuálně dostupnými léčivy není možné tuto genetickou informaci zacílit a z genomu ji odstranit. HIV způsobený AIDS je tedy možné léčit, aktuálně však není možné ho vyléčit. Právě technologie CRISPR-Cas9 by mohla být řešením tohoto problému, neboť díky ní je možné vystřihnout i velmi dlouhé úseky specificky zacílené DNA.
První studie zkoumající možnosti této aplikace jež byly provedeny. V jedné z nich[6] bylo využito SIV (Simian immunodeficiency virus), tj. viru velmi úzce příbuzného s virem HIV, který infikuje člověku blízké primáty (např. makaky). Pomocí dvou specificky navržených sgRNA se podařilo zacílit celkem 3 lokace v začleněném SIV genomu - v 5' LTR, 3' LTR a Gag regionu. Podařilo se vystřihnout dvě části genomu o velikostech 1014 bp a 8447 bp mezi těmito třemi lokacemi, které dohromady tvoří většinou zaintegrované genetické informace viru. Jedinými v genomu hostitele přítomnými pozůstatky genomu SIV byly dva amplikony o velikostech 456 bp a 358 bp. K zanesení CRISPR-Cas9 i obou sgRNA do buněk byl použit AAV vektor.
Jelikož bylo dosaženo úspěšného vystřižení virového genomu z genomu hostitele in vitro i in vivo, konkrétně u makaků, existuje teoretická možnost uplatnění tohoto postupu v léčbě AIDS.
Reference
V tomto článku byl použit překlad textu z článku CRISPR gene editing na anglické Wikipedii.
- ↑ And Science’s 2015 Breakthrough of the Year is.... Science [online]. 2015-12-17. Dostupné online. (anglicky)
- ↑ COHEN, Jon. CRISPR, the revolutionary genetic ‘scissors,’ honored by Chemistry Nobel. Science [online]. 2020-10-07 [cit. 2020-10-07]. Dostupné online. (anglicky)
- ↑ VRTIŠKOVÁ NEJEZCHLEBOVÁ, Lenka. Při vyhlášení Nobelovy ceny se mi roztřásla kolena. Naštěstí jsem seděl, říká český spoluobjevitel vítězných „genetických nůžek“. Deník N [online]. 2020-10-7. Dostupné online.
- ↑ LY, Joseph. Discovering genes responsible for kidney diseases. , 2013. . University of Toronto. . Dostupné online. (anglicky)
- ↑ WAXMONSKY, Nicole. CRISPR 101: Mammalian Expression Systems and Delivery Methods [online]. Addgene blog, 2015-9-24. Dostupné online. (anglicky)
- ↑ MANCUSO, Pietro; CHEN, Chen; KAMINSKI, Rafal. CRISPR based editing of SIV proviral DNA in ART treated non-human primates. Nature Communications. 2020-11-27, roč. 11, čís. 1, s. 6065. Dostupné online [cit. 2021-03-12]. ISSN 2041-1723. DOI 10.1038/s41467-020-19821-7. (anglicky)
Média použitá na této stránce
Autor: Mariuswalter, Licence: CC BY-SA 4.0
DNA Repair after CRISPR-Cas9 double strand break
Autor: Nielsrca, Licence: CC BY-SA 4.0
overview of the transfection and DNA cleaving by CRISPR Cas9 (crRNA and tracrRNA are often joined as one strand of RNA when designing a plasmid)
graphical overview of CRISPR Cas9 plasmid construction