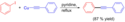Castrovo–Stephensovo párování
Castrovo–Stephensovo párování je křížová párovací reakce acetylidu měďného s arylhalogenidem v pyridinu, kterou vzniká disubstituovaný alkyn a měďný halogenid.[1][2]
Reakci popsali v roce 1963 C. E. Castro a R. D. Stephens.[1][2]
Reakce je podobná dříve známé Rosenmundově–von Braunově syntéze z roku 1914.[3][4] Při ní reagují arylhalogenidy s kyanidem měďným a v roce 1975 bylo vyvinuto vylepšení známé jako Sonogaširova reakce přidáním palladiového katalyzátoru a in situ přípravou organoměďné sloučeniny, což umožnilo použití mědi v katalytickém množství.[5][6]
Příkladem konkrétní reakce může být příprava difenylacetylenu z jodbenzenu a CuC2C6H5 v horkém pyridinu:[1]
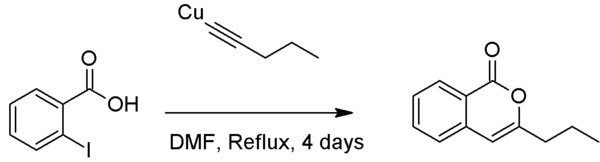
Na rozdíl od Sonogaširova mohou Castrovým–Stephensovým párováním vznikat heterocyklické sloučeniny, podmínkou je přítomnost nukleofilní skupiny v poloze ortho vůči halogenu, často je také třeba takovou reakci provádět v dimethylformamidu (DMF).[7][8]
Reference
V tomto článku byl použit překlad textu z článku Castro–Stephens coupling na anglické Wikipedii.
- ↑ a b c R. D. Stephens; C. E. Castro. The Substitution of Aryl Iodides with Cuprous Acetylides. A Synthesis of Tolanes and Heterocyclics. The Journal of Organic Chemistry. 1963, s. 3313–3315. DOI 10.1021/jo01047a008.
- ↑ a b OWSLEY, D. C.; CASTRO, C. E. Substitution of Aryl Halides with Copper(I) Acetylides: 2-Phenylfuro[3,2-b]pyridine. Org. Synth.. 1972, s. 128. Dostupné online. DOI 10.15227/orgsyn.052.0128. (anglicky); Coll. Vol.. S. 916. (anglicky)
- ↑ Karl W. Rosenmund; Erich Struck. Das am Ringkohlenstoff gebundene Halogen und sein Ersatz durch andere Substituenten. I. Mitteilung: Ersatz des Halogens durch die Carboxylgruppe. Berichte der Deutschen Chemischen Gesellschaft A/B. 1919, s. 1749–1756. Dostupné online. DOI 10.1002/cber.19190520840.
- ↑ Julius von Braun; Gottfried Manz. Fluoranthen und seine Derivate. III. Mitteilung. Justus Liebigs Annalen der Chemie. 1931, s. 111–126. DOI 10.1002/jlac.19314880107.
- ↑ Kenkichi Sonogashira; Yasuo Tohda; Nobue Hagihara. A convenient synthesis of acetylenes: Catalytic substitutions of acetylenic hydrogen with bromoalkenes, iodoarenes and bromopyridines. Tetrahedron Letters. 1975, s. 4467–4470. DOI 10.1016/s0040-4039(00)91094-3.
- ↑ Kenkichi Sonogashira. Development of Pd-Cu catalyzed cross-coupling of terminal acetylenes with sp2-carbon halides. Journal of Organometallic Chemistry. 2002, s. 46–49. DOI 10.1016/s0022-328x(02)01158-0.
- ↑ Batu Gunes; Robert Stevenson. Synthesis of natural isocoumarins, artemidin and 3-propylisocoumarin. The Journal of Organic Chemistry. 1980, s. 1532–1534. DOI 10.1021/jo01296a044.
- ↑ Charles E. Castro; R. Havlin; V. K. Honwad; A. M. Malte; Steve W. Moje. Copper(I) Substitutions. Scope and Mechanism of Cuprous Acetylide Substitutions. Journal of the American Chemical Society. 1969, s. 6464–6470. DOI 10.1021/ja01051a049.
Externí odkazy
 Obrázky, zvuky či videa k tématu Castrovo–Stephensovo párování na Wikimedia Commons
Obrázky, zvuky či videa k tématu Castrovo–Stephensovo párování na Wikimedia Commons
Média použitá na této stránce
Synthesis of 3-n-Propylisocoumarin as detailed in J. Org. Chem., 1980, 45 (8), pp 1532–1534 DOI: 10.1021/jo01296a044
Autor: Původně soubor načetl V8rik na projektu Wikipedie v jazyce angličtina, Licence: CC BY-SA 3.0
Castro-Stephens_application