Chelatace

Chelatace je fyzikálně chemický proces, při němž se organické sloučeniny vážou na kovové kationty (například železo, hořčík, měď, vápník) dvěma nebo více vazbami za vzniku komplexních sloučenin.[1] Organické sloučeniny, které se navazují, jsou nazývány chelatační činidla nebo ligandy. Ty obklopují kationty kovů v jednom či více bodech vazby jako by je svírala klepeta raka. Odtud pochází název chelatace, který je odvozen z řeckého slova chelé (klepeto raka nebo ptačí pařát).
Počet koordinačně-kovalentních vazeb, kterými se ligandy vážou na centrální atom se nazývá dentacita (vaznost). Slovo dentacita je odvozeno od latinského slova dens (zub), neboť navázané ligandy připomínají chrup.
Chelatace se používá v mnoha aplikacích, jako je výroba výživových doplňků, k odstranění toxických kovů z těla, jako kontrastní látka při MRI skenování, při výrobě pomocí homogenních katalyzátorů, při chemické úpravě vody nebo v hnojivech.
Chelatace v organismech
Mnoho biomolekul vykazuje schopnost vázat se na kovové kationty. Patři mezi ně bílkoviny, polysacharidy a nukleové kyseliny, které jsou vynikajícími ligandy pro mnoho kovových iontů. Typickými chelatačními činidly v organismech jsou aminokyseliny (kyselina glutamová a histidin), dikarboxylové kyseliny (hořečnatá sůl kyseliny maleinové) a polypeptidy (fytochelatin).

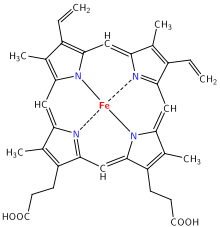
Některé biomolekuly reagují jen s určitými kovy. Mezi takové biomolekuly patří porfyriny, které jsou nezbytné pro život na Zemi. Hem je metaloporfyrin, který váže železo za vzniku hemoglobinu. Ten v živých organismech mimo jiné umožňuje přenos kyslíku červenými krvinkami. Chlorofyl je metaloporfyrin, který váže hořčík a umožňuje fotosyntézu. To je nejdůležitější reakce na Zemi, na které jsou závislé všechny živé organismy.
Mnoho bakterií produkuje ve vodě rozpustné pigmenty, které slouží jako chelatační činidla, nazývaná siderofory. Například druhy bakterie Pseudomonas jsou známé tím, že vylučují pyochelin a pyoverdin, které vážou železo. Nejsilnějším známým chelatačním činidlem je enterobaktin, produkovaný bakterií Escherichia coli.
Chelatace v medicíně
Chelatace se používá v medicíně při otravě těžkými kovy, neboť může zablokovat jejich toxický účinek a vést k jejich snadnějšímu vyloučení z organizmu (například při otravě olovem, k odstranění nadměrného množství mědi u Wilsonovy choroby nebo železa u hemochromatózy). Chelatace stimuluje samoléčebné schopnosti organismu a s její pomocí dochází k pročištění orgánů, tkání a buněk.
Chelatace se také využívá pro zlepšení vstřebávání minerálů organismem. Některé minerály se v chelátové formě lépe vstřebávají, někdy i o několik řádů snadněji oproti pouhé minerální formě.
Nejpoužívanější chelatační činidlo je ethylendiaminotetraoctová kyselina (EDTA), která se váže na těžké kovy a ty jsou pak vyloučeny z organizmu.
Chelatační činidla jsou například používána při výrobě roztoků určených k čištění kontaktních čoček. Na základě chelatace jsou z čoček odstraňovány nežádoucí usazeniny anorganického původu – především vápník, hořčík a sloučeniny solí.
Příklady chelátových ligandů
| Ligand | Zkratka | Počet vazeb |
|---|---|---|
| Acetylaceton | ACAC | 2 |
| Ethylendiamin | EN | 2 |
| 2-(2-Aminoethylamino)ethanol | AEEA | 3 |
| Diethylentriamin | DIEN | 3 |
| Iminodiacetat | IDA | 3 |
| Triethylentetramin | TRIEN, TETA | 4 |
| Triaminotriethylamin | TREN | 4 |
| Nitrilotriacetát | NTA | 4 |
| Bis(salicyliden)ethylendiamin | SALEN | 4 |
| Ethylendiaminotriacetát | TED | 5 |
| Ethylendiamintetraacetát | EDTA | 6 |
| Diethylentriaminpentaacetát | DTPA | 8 |
| Triethylentetraminhexaacetát | TTHA | 10 |
| 1,4,7,10-Tetraazacyclododecan-1,4,7,10-tetraacetát | DOTA | 8 |
| Oxalát | OX | 2 |
| Tartrat | TART | 2 |
| Citrát | CIT | 3 |
| Dimethylglyoxim | DMG | 2 |
| 8-Hydroxychinolin | OXIN | 2 |
| 2,2'-Bipyridin | BPY | 2 |
| 1,10-Phenanthrolin | PHEN | 2 |
| Dimercaptobernsteinsäure | DMSA | 2 |
| 1,2-Bis(diphenylphosphino)ethan | DPPE | 2 |
Související články
Reference
V tomto článku byly použity překlady textů z článků Chelatkomplexe na německé Wikipedii a Chelation na anglické Wikipedii.
Externí odkazy
Média použitá na této stránce
chlorophyll c1 and chlorophyll c2


