Chirální pomocník
Chirální pomocník (chirální pomocná skupina) je funkční skupina nebo molekula, která může vytvořit chirální centrum, které je následně zabudováno do sloučeniny za účelem dosažení požadované stereoselektivity.[1][2] Chiralita obsažená v molekule, která je jako pomocník použita, ovlivňuje stereoselektivitu jedné nebo několika dalších reakcí. Chirální pomocníky je obvykle možné obnovit a poté použít znovu.

Většina biomolekul a léčiv se vyskytuje jako jeden ze dvou možných enantiomerů, a tak je důležité připravovat tyto látky v enantiomerně čisté podobě.[3] Jedním ze způsobů, jak získat čisté enantiomery, jsou právě chirální pomocníci.[4]
Používání chirálních pomocníků zavedli v roce 1975 Elias James Corey[5] (šlo o chirální 8-fenylmenthol) a v roce 1980 Barry Trost (který použil chirální kyselinu mandlovou). Derivát mentholu se obtížně připravuje; roku 1985 objevil J. K. Whitesell trans-2-fenyl-1-cyklohexanol, který je jeho možnou náhradou.
Využití v asymetrické syntéze
Chirální pomocníci se používají jako součásti procesů, při kterých má být regulována stereochemie produktů. Při syntéze makrolidu cytovaricinu, kterou navrhl David A. Evans, považované za klasickou reakci s využitím chirálního pomocníka, se využívá chirální derivát oxazolidinonu při jedné asymetrické alkylaci a čtyřech asymetrických aldolových reakcích, čímž se nastaví absolutní stereochemie na devíti stereocentrech.[6]

Stereoselektivní syntéza s využitím chirálních pomocníků se obvykle skládá ze tří částí. V první se chirální pomocník kovalentně naváže na substrát, v druhé u takto vytvořené sloučeniny proběhne jedna nebo více stereoselektivních reakcí a ve třetí je chirální pomocník odstraněn za podmínek, při kterých nedochází k racemizaci produktu.[4] Kvůli nákladům na použití stechiometrických množství chirálních pomocníků, provádění několika mezireakcí a následnému odstraňování chirálních pomocníků je celý proces zdánlivě neefektivní, ovšem v mnoha případech jde o jediný možný způsob stereoselektivní přípravy dané látky. Procesy se zapojením chirálních pomocníků jsou podrobně prozkoumané a lze je použít v mnoha případech, a tak jsou často časově nejméně náročnými způsoby přípravy enantiomerně čistých produktů.[2]
Produkty takovýchto procesů jsou navíc diastereomery,[7] díky čemuž je možné je poměrně snadno oddělit například sloupcovou chromatografií nebo krystalizací.
8-fenylmenthol
Jedním z prvních využití chirálních pomocníků byla asymetrická Dielsova–Alderova reakce akrylátového esteru (−)-8-fenylmentholu s 5-benzyloxymethylcyklopemtadienem.[5] Produkt této reakce byl přeměněn na jodlakton, meziprodukt Coreyovy symtézy prostaglandinů. Zadní strana molekuly akrylátu je blokována chirálním pomocníkem, díky čemuž cykloadice probíhá na přední straně.

8-fenylmenthol lze připravit z některého z enantiomerů pulegonu,[8] ovšem tento postup není příliš účinný. Vzhledem k širokým možnostem využití tohoto postupu byly vyvinuty i jiné látky využitelné tímto způsobem, například trans-2-fenyl-1-cyklohexanol.[9]
1,1’-Binaftyl-2,2’-diol (BINOL)
1,1’-Binaftyl-2,2’-diol (zkráceně BINOL) se používá jako chirální pomocník od roku 1983.[10][11]

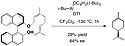
Hisaši Jamamoto použil (R)-BINOL jako chirálního pomocníka při asymetrické syntéze limonenu, jednoho z cyklických monoterpenů. (R)-BINOLmonoerylether byl připravem monosilylací a alkylací (R)-BINOLu. Následně byla provedena redukce organohlinitým činidlem a vznikl limonen, výtěžnost reakce činila 29 % a enantiomerní přebytek měl hodnotu 64 %.[11]

Enantiomerně čisté R-aminokyseliny lze připravit alkylací chirálních derivátů glycinu s využitím axiálně chirálního BINOLu. V závislosti na použitém elektrofilu se diastereomerní přebytek pohybuje od 69 do 86 %.[12]

Navázání BINOLu jakožto chránicí skupiny na aldehyd umožňuje diastereoselektivní reakce arylglyoxalů s Grignardovými činidly za vzniku chráněného atrolaktaldehydu se středním až vysokým diastereomerním přebytkem a dobrou výtěžností.[13]

Trans-2-fenylcyklohexanol

Dalšími látkami, které mohou být použity jako chirální pomocníci, jsou trans a jeho deriváty. Lze je použít při enových reakcích esterů kyseliny glyoxalové.[14]

Při totální syntéze (−)-heptemeronu B a (−)-guanakastepenu E reaguje kyselina glyoxalová, na kterou je navázán trans-2-fenylcyklohexanol, s 2,4-dimethyl-pent-2-enem za přítomnosti chloridu cíničitého a vytváří jako hlavní produkt anti-adukt, který je požadovaným hlavním produktem, a syn-adukt v molárním poměru 10:1.[15]
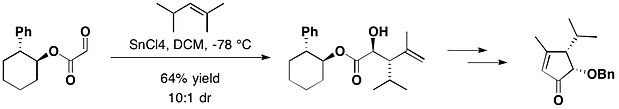
Při nahrazení fenylové skupiny tritylovou (tedy použití trans-2-tritylcyklohexanolu) je diastereoselektivita reakce ještě vyšší. Pomocí této látky lze provést oxidační cyklizaci řízenou chirálním manganistanem.[16]

Oxazolidinony
Chirální pomocníky odvozené od oxazolidinonu, které zavedl David A. Evans, lze použít při mnoha různých stereoselektivních syntézách, jako jsou aldolové reakce,[17] alkylace[18] a Dielsovy–Alderovy reakce.[19][20] Oxazolidinony zde bývají substituovány na pozicích 4 nebo 5. I přes vliv sterických efektů se dají použít při substitucích mnoha různých skupin. Snadno se odstraňují, například hydrolýzou.
Příprava
Oxazolidinony se připravují z aminokyselin nebo aminoalkoholů.

Acylace oxazolidinonů se provádí deprotonací pomocí n-butyllithia a následnou reakcí s acylchloridem.

Využití při alkylacích
Deprotonací oxazolidinonimidů na α uhlíku pomocí silných zásad, jako je diisopropylamid lithný, selektivně vznikají Z-enoláty, u kterých lze poté provést stereoselektivní alkylaci.

Velmi vhodnými substráty pro takovéto reakce jsou aktivované elektrofily, jako například allyl- a benzylhalogenidy.
Využití při aldolových reakcích
Chirální oxazolidinony se nejčastěji používají při stereoselektivních aldolových reakcích.
Mírnou enolizací Lewisovou kyselinou dibutylbortriflátem a zásadou diisopropylethylaminem se vytváří Z-enolát, u něhož posléze dojde k diastereoselektivní aldolové reakci s aldehydem.

Kamforsultam
Kamforsultam, také nazývaný Oppolzerův sultam, se také používá jako chirální pomocník.

Při totální syntéze manzacidinu B se používá k asymetrické tvorbě oxazolinového cyklu. Na rozdíl od oxazolidinonových chirálních pomocníků má kamforsultam výraznou (2S,3R)-selektivitu.[21]

Také se používá při Michaelových reakcích. Stereoselektivní Michaelovou adicí thiolů na N-methakryloylkamforsultam za přítomnosti organolithné zásady vznikají produkty s vysokou diastereoselektivitou.[22]

Kamforsultam může být chirálním pomocníkem i u asymetrických Claisenových přesmyků. Za přítomnosti butylhydroxytoluenu zachytávajícího volné radikály se toluenový roztok aduktu geraniolu s kamforsultamem zahřívá v uzavřené nádobě při 140 °C, přičemž je hlavním produktem (2R,3S)-izomer se 72% výtěžností, přičemž jsou zachována obě stereocentra.[23]

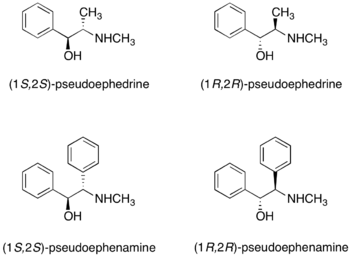
Pseudoefedrin
(R,R)-, i (S,S)-pseudoefedrin lze použít jako chirální pomocníky.[24] Pseudoefedrin reaguje s karboxylovými kyselinami, jejich anhydridy a halogenidy za vzniku pseudoefedrinamidu.
Z karbonylových sloučenin lze snadno odštěpit α protony pomocí nenukleofilních zásad za tvorby enolátů, které se mohou účastnit dalších reakcí. Stereochemie vzniklé adiční sloučeniny (například s halogenalkanem) je řízena methylovou skupinou. Jakýkoliv adukt vytvořený tímto způsobem tak bude v poloze syn- vůči methylové a anti- vůči hydroxylové skupině. Pseudoefedrin se následně odstraní rozštěpením amidové vazby vhodným nukleofilem.
Příprava
Lze zakoupit oba enantiomery pseudoefedrinu. Racemát se prodává jako dekongesční léčivo Sudafed. Protože jej lze použít na výrobu metamfetaminu, tak je jeho prodej pro výzkumné účely regulován; alternativou může být při alkylačních reakcích použití pseudoefenaminových chirálních pomocníků.[25] Pseudoefenamin není snadno komerčně dostupný, ale dá se připravit z benzilu a nelze z něj získat amfetaminy.[26]
Pseudoefedrinamidy se obvykle připravují acylací pomocí acylhalogenidů nebo acylanhydridů.[27]
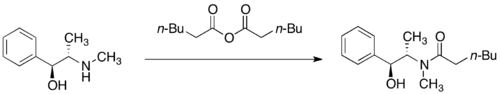
Alkylační reakce
Pseudoefedriamidy jaou deprotonovány silnými zásadami, jako je například diisopropylamid lithný, na příslušné (Z)-enoláty. Alkylace těchto lithných enolátů je vysoce stereoselektivní.

Diastereoselektivita je důsledkem toho, že molekuly lithných alkoxidů jsou zde z jedné strany blokovány sekundárními alkoxidy a molekulami rozpouštědla spojenými s lithnými kationty. Diastereoselektivita reakce závisí na množství chloridu lithného a na druhu rozpouštědla (tím nejčastěji bývá tetrahydrofuran). Obvykle stačí k nasycení roztoku enolátu 4 až 6 ekvivalentů chloridu lithného.
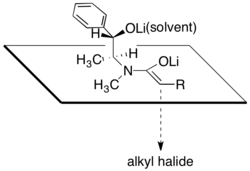
Jedna z výhod provádění asymetrických alkylací pomocí pseudoefedrinamidů spočívá v tom, že amidy enolátů jsou většinou dostatečně silnými nukleofily, aby reagovaly s primárními a sekundárními halogenidy při teplotách od 78 °C do 0 °C. Kvartérních uhlíková centra lze také vytvářet také alkylací α rozvětvených amidenolátů, i když při použití méně reaktivních elektrofilů je potřeba přidat do reakční směsi N,N′-dimethylpropylenmočovinu.[28]
Odstranění
Za vhodných podmínek mohou být pseudoefedrinamidy přeměněny na enantiomerně čistší karboxylové kyseliny, alkoholy, aldehydy a ketony.
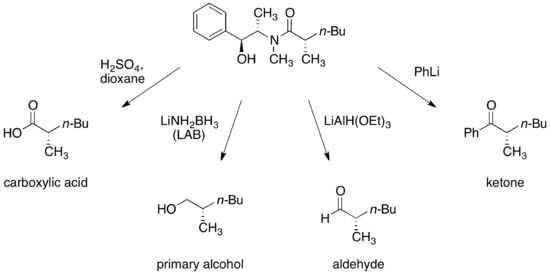
Následně může být chirální pomocník obnoven a znovu použit.
Terc-butansulfinamid
Terc-butansulfinamid je sulfinamid, jehož možné využití při asymetrické syntéze objevil a významně rozvinul Jonathan A. Ellman.[29][30] Tato látka tak bývá často nazývána Ellmanův chirální pomocník nebo Ellmanův sulfinamid.

Příprava
Z terc-butyldisulfidu lze připravit oba enantiomery terc-butansulfinamidu, a to ve dvou krocích: nejprve katalytickou asymetrickou oxidací vznikne, s vysokou výtěžností i velkým enantiomerním přebytkem, disulfid, jenž následně reaguje s amidem lithným v amoniaku za vzniku enantiomerně čistého produktu s opačnou konfigurací.

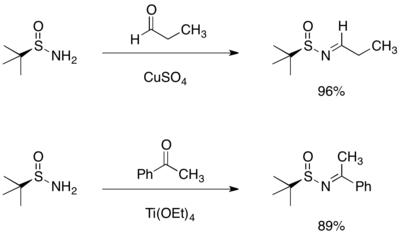
Kondenzace terc-butansulfinamidu s aldehydy a ketony mívají vysokou výtěžnost a vytvářejí pouze (E)-izomer příslušného N.
SAMP/RAMP
Dieter Enders a Elias James Corey objevili a rozvinuli alkylační reakce chirálních látek (S)-1-amino-2-methoxymethylpyrrolidinu (SAMP) a (R)-1-amino-2-methoxymethylpyrrolidinu (RAMP).[31][32]
Příprava
SAMP se připravuje v šesti krocích z (S)-prolinu a RAMP z kyseliny (R)-glutamové.

Alkylace
Kondenzací SAMPu nebo RAMPu s aldehydy a ketony vznikají (E)-hydraziny. Následná deprotonace diisopropylamidem lithným a přidání alkylhalogenidu vedou k tvorbě alkylovaného produktu; chirální pomocník může být odstraněn hydrolýzou nebo ozonolýzou.

Využití v průmyslu
Chirální pomocníky lze obvykle použít při velkém počtu různých asymetrických syntéz. Používají se například při výrobě léčiv.[2]
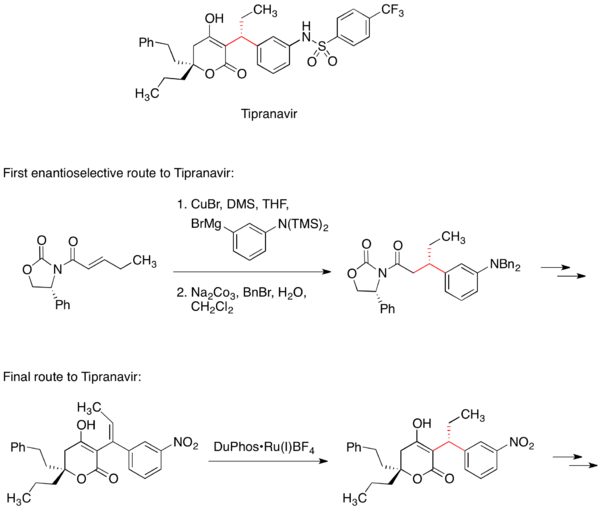
Tipranavir
Tipranavir je inhibitor proteázy HIV používaný na léčbu AIDS. První enantioselektivní metoda výroby této látky zahrnovala konjugovanou adici Gilmanova činidla na chirální Michaelův akceptor.[33] Chirální oxazolidinon v Michaelově akceptoru určuje stereochemii jednoho či dvou stereocenter molekuly.
Později vyvinutý postup výroby Tipranaviru neobsahuje reakci s chirálním pomocníkem, místo toho se stereocentrum vytvoří asymetrickou hydrogenací.[34]
Atorvastatin
Vápenatá sůl atorvastatinu se, prodávaná pod obchodním názvem Lipitor, používá ke snížení koncentrace cholesterolu v krvi. Při první známé metodě asymetrické syntézy atorvastatinu byla využita diastereoselektivní aldolová reakce chirálního esteru při tvorbě jednoho ze dvou alkoholových stereocenter.[35] Při průmyslové výrobě vzniká toto stereocentrum pomocí kyseliny isoaskorbové.[36]

Reference
V tomto článku byl použit překlad textu z článku Chiral auxiliary na anglické Wikipedii.
- ↑ Key Chiral Auxiliary Applications (Second Edition)(ed.: Roos, G.), Academic Press, Boston, 2014. ISBN 978-0-12-417034-6
- ↑ a b c F. Glorius; Y. Gnas. Chiral Auxiliaries — Principles and Recent Applications. Synthesis. 2006, s. 1899–1930.
- ↑ Fakhreddin Jamali. Drug Stereochemistry: Analytical Methods and Pharmacology. Příprava vydání Irving W. Wainer. [s.l.]: Marcel Dekker, Inc., 1993. Dostupné online. ISBN 978-0-8247-8819-3. Kapitola Chapter 14: Stereochemically Pure Drugs: An Overview, s. 375–382.
- ↑ a b D. A. Evans; G. Helmchen; M. Rüping. Asymmetric Synthesis — The Essentials. Příprava vydání M. Christmann. [s.l.]: Wiley-VCH Verlag GmbH & Co., 2007. Dostupné online. ISBN 978-3-527-31399-0. Kapitola Chiral Auxiliaries in Asymmetric Synthesis, s. 3–9.
- ↑ a b E. J. Corey; H. E. Ensley. Preparation of an Optically Active Prostaglandin Intermediate via Asymmetric Induction. Journal of the American Chemical Society. 1975, s. 6908–6909. PMID 1184891.
- ↑ K. C. Nicolau. Classics in Total Synthesis. New York, New York: Wiley-VCH, 2008. ISBN 978-3-527-29231-8. S. 485–508.
- ↑ J. P. Miller. ChemInform Abstract: Recent Advances in Asymmetric Diels-Alder Reactions. Synthesis. 2013.
- ↑ E. J. Corey; H. E. Ensley; C. A. Parnell. Convenient Synthesis of a Highly Efficient and Recyclable Chiral Director for Asymmetric Induction. The Journal of Organic Chemistry. 1978, s. 1610–1611.
- ↑ D. L. Comins; J. D. Salvador. Efficient Synthesis and Resolution of trans-2-(1-Aryl-1-methylethyl)cyclohexanols: Practical Alternatives to 8-P henylmenthol. The Journal of Organic Chemistry. 1993, s. 4656–4661.
- ↑ Jean Michel Brunel. BINOL: A Versatile Chiral Reagent. Chemical Reviews. 2005, s. 857–898. PMID 15755079.
- ↑ a b Soichi Sakane; Junya Fujiwara; Keiji Maruoka; Hisashi Yamamoto. Chiral leaving group. Biogenetic-type asymmetric synthesis of limonene and bisabolenes. Journal of the American Chemical Society. 1983, s. 6154–6155.
- ↑ Kiyoshi Tanaka; Mija Ahn; Yukari Watanabe; Kaoru Fuji. Asymmetric synthesis of uncommon α-amino acids by diastereoselective alkylations of a chiral glycine equivalent. Tetrahedron: Asymmetry. 1996-06-01, s. 1771–1782.
- ↑ Paola Maglioli; Ottorino De Lucchi; Giovanna Delogu; Giovanni Valle. Highly diastereoselective reduction and addition of nucleophiles to binaphthol-protected arylglyoxals. Tetrahedron: Asymmetry. 1992-01-01, s. 365–366.
- ↑ George Buchi; Dennis E. Vogel. A new method for the preparation of γ,δ-unsaturated ketones via Claisen rearrangement. The Journal of Organic Chemistry. 1985, s. 4664–4665.
- ↑ Aubry K. Miller; Chambers C. Hughes; Joshua J. Kennedy-Smith; Stefan N. Gradl; Dirk Trauner. Total Synthesis of (−)-Heptemerone B and (−)-Guanacastepene E. Journal of the American Chemical Society. 2006, s. 17057–17062. PMID 17177458.
- ↑ trans-2-Tritylcyclohexanol as a Chiral Auxiliary in Permanganate-Mediated Oxidative Cyclization of 2-Methylenehept-5-enoates: Application to the Synthesis of trans-(+)-Linalool Oxide. Organic Letters. 2014, s. 5104–5107. PMID 25225741.
- ↑ D. A. Evans; J. Bartroli; T. L. Shih. Enantioselective aldol condensations. 2. Erythro-selective chiral aldol condensations via boron enolates. Journal of the American Chemical Society. 1981, s. 2127–2129.
- ↑ D. A. Evans; M. D. Ennis; D. J. Mathre. Asymmetric Alkylation Reactions of Chiral Imide Enolates. A Practical Approach to the Enantioselective Synthesis of a-Substituted Carboxylic Acid Derivatives. Journal of the American Chemical Society. 1982, s. 1737–1739.
- ↑ D. A. Evans; K. T. Chapman; J. Bisaha. New Asymmetric Diels-Alder Cycloaddition Reactions. Chiral α,β-Unsaturated Carboximides as Practical Chiral Acrylate and Crotonate Dienophile Synthons. Journal of the American Chemical Society. 1984, s. 4261–4263.
- ↑ D. A. Evans; K. T. Chapman; D. T. Hung; A. T. Kawaguchi. Transition State π-Solvation by Aromatic Rings: An Electronic Contribution to Diels-Alder Reaction Diastereoselectivity. Angewandte Chemie International Edition. 1987, s. 1184–1186.
- ↑ Tetsuro Shinada; Kentaro Oe; Yasufumi Ohfune. Efficient total synthesis of manzacidin B. Tetrahedron Letters. 2012-06-27, s. 3250–3253.
- ↑ Wen-Jiuan Tsai; Yi-Tsong Lin; Biing-Jiun Uang. Asymmetric Michael addition of thiols to (1R,2R,4R)-(−)-2,10-N-enoylcamphorsultam. Tetrahedron: Asymmetry. 1994-07-01, s. 1195–1198.
- ↑ Ken-ichi Takao; Shu Sakamoto; Marianne Ayaka Touati; Yusuke Kusakawa; Kin-ichi Tadano. Asymmetric Construction of All-Carbon Quaternary Stereocenters by Chiral-Auxiliary-Mediated Claisen Rearrangement and Total Synthesis of (+)-Bakuchiol. Molecules. 2012-11-08, s. 13330–13344. PMID 23138536.
- ↑ Pseudoephedrine as a Practical Chiral Auxiliary for the Synthesis of Highly Enantiomerically Enriched Carboxylic Acids, Alcohols, Aldehydes, and Ketones. Journal of the American Chemical Society. 1997, s. 6496–6511.
- ↑ A. G. Myers; M. R. Morales; K. T. Mellem. Pseudoephenamine: A Practical Chiral Auxiliary for Asymmetric Synthesis. Angewandte Chemie. 2012, s. 4646–4649. Dostupné online. PMID 22461381.
- ↑ Kevin T. Mellem; A. G. Myers. A Simple, Scalable Synthetic Route to (+)- and (−)-Pseudoephenamine. Organic Letters. 2013, s. 5594–5597. ISSN 1523-7060. PMID 24138164.
- ↑ A. G. Myers; B. H. Yang; L. McKinstry; D. J. Kopecky; J. L. Gleason. Pseudoephedrine as a Practical Chiral Auxiliary for the Synthesis of Highly Enantiomerically Enriched Carboxylic Acids, Alcohols, Aldehydes, and Ketones. Journal of the American Chemical Society. 1997, s. 6496–6511.
- ↑ D. A. Kummer; W. J. Chain; M. R. Morales; O. Quiroga; A. G. Myers. Stereocontrolled Alkylative Construction of Quaternary Carbon Centers. Journal of the American Chemical Society. 2008, s. 13231–13233. PMID 18788739.
- ↑ Guangcheng Liu; Derek A. Cogan; Jonathan A. Ellman. Catalytic Asymmetric Synthesis of tert -Butanesulfinamide. Application to the Asymmetric Synthesis of Amines. Journal of the American Chemical Society. 1997, s. 9913–9914. ISSN 0002-7863.
- ↑ Jonathan A. Ellman; T. D. Owens; T. P. Tang. N-tert-Butanesulfinyl Imines: Versatile Intermediates for the Asymmetric Synthesis of Amines. Accounts of Chemical Research. 2002, s. 984–995. PMID 12437323.
- ↑ Elias James Corey; Dieter Enders. Applications of N,N-dimethylhydrazones to synthesis. Use in efficient, positionally and stereochemically selective C-C bond formation; oxidative hydrolysis to carbonyl compounds. Tetrahedron Letters. 1976, s. 3–6.
- ↑ L. Kurti; B. Czako. Strategic Applications of Named Reactions in Organic Synthesis. Burlington, MA: Elsevier Academic Press, 2005. ISBN 978-0-12-369483-6. S. 150–151.
- ↑ Tipranavir (PNU-140690): A Potent, Orally Bioavailable Nonpeptidic HIV Protease Inhibitor of the 5,6-Dihydro-4-hydroxy-2-pyrone Sulfonamide Class. Journal of Medicinal Chemistry. 1998, s. 3467–3476. PMID 9719600.
- ↑ Stéphane Caron. Practical Synthetic Organic Chemistry. [s.l.]: John Wiley & Sons, Inc., 2011. Dostupné online. ISBN 978-0-470-03733-1. Kapitola Chapter 15: Synthetic Route Development of Selected Contemporary Pharmaceutical Drugs, s. 666–670.
- ↑ Inhibitors of Cholesterol Biosynthesis. 3. Tetrahydro-4-hydroxy-6-[2-(lH-pyrrol-l-yl)ethyl]-2H-pyran-2-one Inhibitors of HMG-CoA Reductase. 2. Effects of Introducing Substituents at Positions Three and Four of the Pyrrole Nucleus. Journal of Medicinal Chemistry. 1991, s. 357–366. PMID 1992137.
- ↑ Jie Jack Li; Douglas S. Johnson; Drago R. Sliskovic; Bruce D. Roth. Contemporary Drug Synthesis. [s.l.]: John Wiley & Sons, Inc., 2004. Dostupné online. ISBN 978-0-471-21480-9. Kapitola Chapter 9. Atorvastatin Calcium (Lipitor), s. 113–125.
Média použitá na této stránce
Autor: Matrix8086, Licence: CC BY-SA 4.0
The glyoxylate reacted with 2,4-dimethyl-2- pentane with trans-2-phenylcyclohexanol as a chiral auxiliary
Autor: Matrix8086, Licence: CC BY-SA 4.0
Lithium base promoted stereosclcctive Michael addition of thiols to N-mcthacryloylcamphorsultam produced the corresponding addition products in high diastereoselectivity.
Autor: unknown, Licence:
Autor: Matrix8086, Licence: CC BY-SA 4.0
Camphorsultam was used as a chiral auxiliary in Claisen rearrangement.
Autor: Matrix8086, Licence: CC BY-SA 4.0
Alkylation on amino acids via BINOL as a chiral auxiliary 2
Autor: Jammercer, Licence: CC BY-SA 3.0
Chemdraw figures
Autor: Matrix8086, Licence: CC BY-SA 4.0
The chiral camphorsultam was found to be a superior chiral auxiliary to the oxazolidinone in view of the single asymmertric induction
Chemical diagram for trans-2-phenylcyclohexanol
Autor: Matrix8086, Licence: CC BY-SA 4.0
Trans-2-phenylcyclohexanol was used in ene reaction as a chiral auxiliary.
Autor: Matrix8086, Licence: CC BY-SA 4.0
First utilization of BINOL as a chiral auxiliary
Autor: Matrix8086, Licence: CC BY-SA 4.0
Trans-2-cumylcyclohexanol was used in asymmetric permanganate-mediated oxidative cyclization.
Structure of some evans auxiliaries
Autor: Matrix8086, Licence: CC BY-SA 4.0
Diastereoselective addition between Grignard and BINOL protected aldehyde
Chemical diagram for (R)-BINOL
Autor: Yang Zhao, Licence: CC BY-SA 3.0
general depiction of Enders' SAMP/RAMP hydrazone alkylation reaction.
Structure of the Oppolzer sultam