Chiralita


Chiralita označuje asymetrii prostorového rozložení objektu (např. molekuly), která je důležitá v některých oblastech vědy.
Jako chirální se označuje takový objekt, který není totožný se svým zrcadlovým obrazem, nemá střed ani rovinu symetrie, avšak může mít rotační osu symetrie. Vztah mezi objektem a jeho obrazem je podobný jako vztah mezi levou a pravou rukou. Chirální objekt a jeho obraz se označují jako enantiomorfy, v případě molekul se hovoří o enantiomerech.
Objekty, které nejsou chirální, se označují jako achirální. Achirální objekty mohou být ztotožněny se svým zrcadlovým obrazem.
Objekty, které se vyskytují pouze v jedné formě, se označují jako homochirální (např. přírodní aminokyseliny nebo sacharidy).
Chiralita v chemii
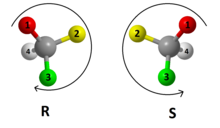
Chiralita je běžná zejména u molekul organických látek. Chirální molekula obsahuje jeden nebo více středů chirality (chirálních atomů), což jsou atomy, které mají své sousedy navázány zrcadlově asymetricky. Většinou se jedná o atom uhlíku se čtyřmi různými substituenty. Pro označení konfigurace na chirálním atomu se používají stereodeskriptory R a S. Postaví-li se model molekuly tak, aby substituent s nejnižší prioritou směřoval dozadu, potom pravotočivá resp. levotočivá orientace v popředí rozmístěných zbylých substituentů ve směru klesající priority udává R resp. S konfiguraci. Priorita se určuje nejprve dle protonového čísla bezprostředně vázaného atomu, dále hmotnost, v případě izotopů. Při shodě se zohledňuje priorita v následné sféře porovnávaných substituentů. Při výskytu násobné vazby se posuzuje takto vázaný atom jako kdyby jich bylo navázán násobný počet, avšak případný následný řetězec je dále vázaný jen na jednom z nich, a na zbylých jsou jen tzv. "fantomové atomy", atd. (jedná se o Cahnova-Ingoldova-Prelogova pravidla[1]).
Základní stavební látky organismů (sacharidy, bílkoviny i nukleové kyseliny) mají chirální molekuly, tedy existují ve formě alespoň dvou optických izomerů (platí, že má-li molekula n středů chirality, je počet optických izomerů roven 2n).
Chiralita chemické látky je také podmínkou pro její optickou aktivitu.
Dva izomery se všemi optickými centry s inverzní konfigurací se nazývají enantiomery a mají shodnou většinu fyzikálních a chemických vlastností (teplota tání, rozpustnost), liší se znaménkem optické otáčivosti, mohou se lišit v chemické reaktivitě s opticky aktivními činidly a mohou tvořit chirální krystaly. Dva izomery s alespoň jedním stejně a alespoň jedním opačně konfigurovaným centrem chirality se nazývají diastereomery a mají rozdílné fyzikální a chemické vlastnosti.
Zdrojem molekulární chirality může být jaderná chiralita, která se díky zesílení například autokatalytickou reakcí projeví makroskopicky.[2]
Chiralita v biologii
Protože základní stavební látky biologických systémů (sacharidy, bílkoviny i nukleové kyseliny) jsou chirální, přičemž organismy zpravidla využívají jen jednu z konfigurací, je chirálně závislá i biologická účinnost mnohých dalších látek. Nicméně lze dosáhnout i reakcí mezi různými chiralitami.[3] Existuje hypotéza že „levoruká“ chiralita v biologii mohla být způsobena α-deuterovaným (jinak achirálním) glycinem jako katalyzátorem a následným šíření této preference na jiné molekuly.[4]
V případě sacharidů a aminokyselin je běžnější označení optických antipodů pomocí D, L systému, který vyplývá z tzv. Fischerovy projekce založené na konfiguraci nejjednoduššího monosacharidu - glyceraldehydu. Analogicky k R, S systému označování optických izomerů, stereodeskriptory D a L označují absolutní konfiguraci. Byly pojmenovány dle optické otáčivosti sacharidů z latinského dexter (pravý) a laevus (levý). S optickou otáčivostí obecně však nesouvisí, např. L-alanin je opticky pravotočivý.
Odlišná konfigurace přitom může způsobovat buď neúčinnost (známým[zdroj?] příkladem je vitamín C a jeho výživově neúčinný protějšek), nebo mít jiné, mnohdy i fatální účinky. To se týká zejména odlišného působení u látek chemické regulace (hormony, alkaloidy apod.). K jedovatosti přitom stačí změna v jednom centru chirality u velké makromolekuly – např. posttranslační nahrazení α-L-aminokyseliny za α-D-aminokyselinu v proteinovém řetězci je základem účinnosti některých bílkovinných antibiotik či jedů (jedy pralesních žab).[5]
Na chirální konfiguraci záleží také u vyráběných protijedů (antidot) a mnohých léčiv. Proto je nutné dbát na důslednou separaci enantiomerů ve farmakologii. K tomu byla vyvinuta celá řada účinných metodik.[6]
Úzce související oblastí je i působení na smysly živočichů. Enantiomery mohou mít úplně odlišné senzorické vlastnosti, což je dáno chiralitou smyslových receptorů. Známým příkladem jsou látky způsobující různé vůně např. citrusového ovoce (limonen a příbuzné sloučeniny) či vůně kuchyňského koření (karvon a příbuzné sloučeniny pro mátovou, kmínovou a fenyklovou vůni). Změna v jednom centru chirality u esterů methylthiohexanolu může změnit ovocnou vůni ve čpavou cibulovou či sirnou.[7]
Chiralita v optice
Látky s chirálními molekulami stáčejí rovinu polarizovaného světla.
Chiralita v částicové fyzice
Chiralita se uplatňuje také při popisu elementárních částic hmoty a jejich interakcí. Chiralita zde vystupuje i jako kvantové číslo jistých kvantových stavů (vlastní číslo operátoru chirality, kterým je tzv. pátá Diracova matice ).[8]
Kvantové stavy leptonů a kvarků se popisují pomocí dirakovských bispinorů. S výhodou se využívá rozkladu stavu do dvou složek s definovanou chiralitou (levotočivé – "L" a pravotočivé – "R"):[8]
Ukazuje se, že v silných interakcích se projevuje dobrá chirální symetrie, narušená pouze díky nenulovosti klidových hmotností částic,[9] slabé interakce jsou výrazně chirálně asymetrické – v interakčním lagrangiánu vystupují pravotočivé a levotočivé složky odlišně.[10]
Reference
- ↑ Cahn-Ingold-Prelogova pravidla pro určování R/S. tigger.uic.edu [online]. [cit. 2013-07-14]. Dostupné v archivu pořízeném dne 2012-01-18.
- ↑ http://forms.asm.org/microbe/index.asp?bid=45725 Archivováno 13. 9. 2010 na Wayback Machine. – Reexamining the Riddle of Homochirality
- ↑ Through the looking glass: A cross-chiral reaction challenges our definition of life. phys.org [online]. [cit. 2024-10-24]. Dostupné online.
- ↑ TASKER, Elizabeth. Why is life left-handed? The answer is in the stars. phys.org [online]. 2015-07-21 [cit. 2023-02-13]. Dostupné online. (anglicky)
- ↑ SMITH, Silas W. Chiral Toxicology: It's the Same Thing…Only Different. S. 4–30. Toxicological Sciences [online]. 4. květen 2009. Svazek 110, čís. 1, s. 4–30. Dostupné online. ISSN 1096-0929. DOI 10.1093/toxsci/kfp097. (anglicky)
- ↑ Bhupinder Singh Sekhon. Enantioseparation of Chiral Drugs – An Overview. S. 1584–1594. International Journal of PharmTech Research [online]. Duben-červen 2010. Svazek 2, čís. 2, s. 1584–1594. PDF [1]. ISSN 0974-4304. (anglicky)
- ↑ BENTLEY, Ronald. The Nose as a Stereochemist. Enantiomers and Odor. S. 4099–4112. Chemical Reviews [online]. 15. srpen 2006. Svazek 106, čís. 9, s. 4099–4112. PDF [2]. DOI 10.1021/cr050049t. (anglicky)
- ↑ a b FORMÁNEK, Jiří. Úvod do relativistické kvantové mechaniky a kvantové teorie pole. Díl 1. 2. vyd. Praha: Univerzita Karlova v Praze, Nakladatelství Karolinum, 2000. 346 s. ISBN 80-246-0060-9. Kapitola 3.1, s. 119–120.
- ↑ CHENG Ta-Pei, LI Ling-Fong. Gauge Theory of Elementary Particle Physics. Oxford: Clarendon Press, 1984. (anglicky) Ruský překlad: Kalibrovočnyje teorii v fizike elementarnych častic. Moskva: Vydavatelství Mir, 1987. 624 s. Kapitola 5, s. 152–201
- ↑ Cheng, Li; kapitola 11, s. 387–418
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Chiralita na Wikimedia Commons
Obrázky, zvuky či videa k tématu Chiralita na Wikimedia Commons
Média použitá na této stránce
Autor: Y tambe, Licence: CC BY-SA 3.0
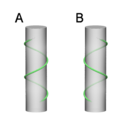
Diagram of helix. (A) right-handed, (B) left-handed.
Autor: Jordi picart, Licence: CC BY-SA 3.0
Assignació de les configuracions R i S en un centre quiral.
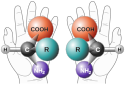
Amino Acid Chirality chirality with hands from http://www.nai.arc.nasa.gov/ A "chiral" molecule is one that is not superposable with its mirror image. Like left and right hands that have a thumb, fingers in the same order, but are mirror images and not the same, chiral molecules have the same things attached in the same order, but are mirror images and not the same. Although most amino acids can exist in both left and right handed forms, Life on Earth is made of left handed amino acids, almost exclusively. No one knows why this is the case. However, Drs. John Cronin and Sandra Pizzarello have shown that some of the amino acids that fall to earth from space are more left than right. Thus, the fact that we are made of L amino acids may be because of amino acids from space. Why do amino acids in space favor L? No one really knows, but it is known that radiation can also exist in left and right handed forms. So, there is a theory called the Bonner hypothesis, that proposes that left handed radiation in space (from a rotating neutron star for example) could lead to left handed amino acids in space, which would explain the left handed amino acids in meteorites. This is still speculative but our paper makes it much more plausible. In fact, this observations was one of the main reasons why we pursued this research. Although there were theories about how the amino acids could form in space in the ice, no one had shown that it was viable to make amino acids this way, until now.