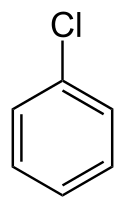
Chlorbenzen
| Chlorbenzen | |
|---|---|
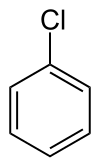 Strukturní vzorec chlorbenzenu | |
 3D model molekuly chlorbenzenu | |
| Obecné | |
| Systematický název | chlorbenzen |
| Ostatní názvy | monochlorbenzen, benzenchlorid, fenylchlorid |
| Anglický název | Chlorobenzene |
| Německý název | Chlorbenzol |
| Sumární vzorec | C6H5Cl |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 108-90-7 |
| EC-no (EINECS/ELINCS/NLP) | 203-628-5 |
| Indexové číslo | 602-033-00-1 |
| PubChem | 7964 |
| SMILES | Clc1ccccc1 |
| InChI | InChI=1/C6H5Cl/c7-6-4-2-1-3-5-6/h1-5H |
| Číslo RTECS | CZ0175000 |
| Vlastnosti | |
| Molární hmotnost | 112,56 g/mol |
| Teplota tání | −45 °C |
| Teplota varu | 131 °C |
| Hustota | 1,11 g/cm3 |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H226 H332 H411 |
| R-věty | R10 R20 R51/53 |
| S-věty | (S2) S24/25 S61 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Chlorbenzen je aromatická organická sloučenina se sumárním vzorcem C6H5Cl. Tato bezbarvá hořlavá kapalina je běžně používaným rozpouštědlem a také meziproduktem pro výrobu dalších chemikálií.
Použití
Chlorbenzen se dříve používal při výrobě některých pesticidů, zejména DDT reakcí s chloralem (trichloracetaldehydem), ale toto použití již není aktuální, vzhledem k výraznému omezení používání DDT. V určité době byl chlorbenzen hlavním prekurzorem při výrobě fenolu:[2]
- C6H5Cl + NaOH → C6H5OH + NaCl
V roce 2005 bylo hlavní oblastí použití chlorbenzenu jeho využití jako meziprodukt pro výrobu herbicidů, barviv a pryže. Chlorbenzen se používá také jako vysokovroucí rozpouštědlo pro mnoho průmyslových aplikací a v laboratoři. Specifickým použitím je nitrace chlorbenzenu na nitrochlorbenzen, který se pak převádí na fenolové, anisolové a anilinové deriváty.[3]
Syntéza
Chlorbenzen byl poprvé popsán v roce 1851, kdy byl připraven reakcí fenolu a chloridu fosforečného. Nyní se vyrábí chlorací benzenu za přítomnosti katalytického množství Lewisovy kyseliny, například chloridu železitého:

Katalyzátor zesiluje elektrofilní účinek chloru. Protože je chlor elektronegativní, C6H5Cl vykazuje sníženou citlivost na jiné elektrofily. Z tohoto důvodu vzniká při chloračním procesu pouze malé množství dichlor- a trichlorbenzenu.
Bezpečnost
Chlorbenzen vykazuje „nízkou až mírnou“ toxicitu, jak odpovídá dávce LD50 2,9 g/kg.[3]
Reference
V tomto článku byl použit překlad textu z článku Chlorobenzene na anglické Wikipedii.
- ↑ a b Chlorobenzene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Manfred Weber, Markus Weber, Michael Kleine-Boymann, “Phenol” in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2005.
- ↑ a b Manfred Rossberg et al. “Chlorinated Hydrocarbons” in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2006.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorbenzen na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorbenzen na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Space-filling model of the chlorobenzene molecule
chlorination of benzene