Chlorid germaničitý
| Chlorid germaničitý | |
|---|---|
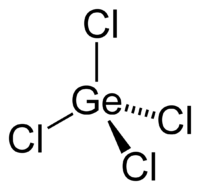 Strukturní vzorec chloridu germaničitého | |
 Čistý chloridu germaničitého | |
| Obecné | |
| Systematický název | Chlorid germaničitý |
| Anglický název | Germanium tetrachloride |
| Německý název | Germanium(IV)-chlorid |
| Sumární vzorec | GeCl4 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 10038-98-8 |
| PubChem | 66226 |
| SMILES | Cl[Ge](Cl)(Cl)Cl |
| InChI | 1S/Cl4Ge/c1-5(2,3)4 |
| Vlastnosti | |
| Molární hmotnost | 214,40 g/mol |
| Teplota tání | −49,5 °C |
| Teplota varu | 86,5 °C |
| Hustota | 1,879 g.cm−3 (20 °C) 1,844 g.cm−3 (30 °C) |
| Index lomu | 1,464 |
Některá data mohou pocházet z datové položky. | |
Chlorid germaničitý, GeCl4, je anorganická sloučenina germania a chloru. Je to bezbarvá, dýmavá kapalina s kyselým zápachem.[1] Používá se jako prekurzor pří výrobě čistého germania. Nachází také využití při výrobě optických vláken.
Výroba
Většina germania se získává z popílků vzniklých při zpracování rud zinku a mědi, ale také při spalování uhlí.
Chlorid germaničitý lze připravit rozpouštěním oxidu germaničitého v koncentrované kyselině chlorovodíkové a následnou frakční destilací. Přečištěný GeCl4 můžeme následně hydrolyzovat a získat velmi čistý GeO2.[2]
Přípravu je možné provést i klasicky, reakcí kovového germania s chlorem za zvýšené teploty.[3]
Využití
Chlorid germaničitý je důležitým prekurzorem pro přípravu organokovových sloučenin germania, ale z ekologických důvodů je snaha využívat syntetické metody neobsahující chlor.[4]
Optická vlákna
Díky možnosti snadné přeměny chloridu germaničitého na oxid se využívá při výrobě optických vláken. Směs chloridu křemičitého a germaničitého je zaváděna do vyhřáté skleněné formy, kde dochází k jejich oxidaci za vzniku skelné směsi.[5] Oxid germaničitý má vysoký index lomu, takže lze obsahem chloridu germaničitého cíleně nastavit index lomu vznikajícího optického vlákna.[2][6] Koncentrace oxidu germaničitého je zpravidla okolo čtyř procent.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Germanium tetrachloride na anglické Wikipedii.
- ↑ GREENWOOD, Norman Neill. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. S. 462.
- ↑ a b Germanium_dioxide. www.chemeurope.com [online]. [cit. 2023-02-02]. Dostupné online.
- ↑ HOUSECROFT, Catherine E. Anorganická chemie. Vyd. 1. vyd. Praha: Vysoká škola chemicko-technologická v Praze xxx, 1119 s. s. ISBN 978-80-7080-872-6, ISBN 80-7080-872-1. S. 446.
- ↑ GLAVINOVIĆ, Martin; KRAUSE, Michael; YANG, Linju. A chlorine-free protocol for processing germanium. Science Advances. 2017-05-05, roč. 3, čís. 5, s. e1700149. Dostupné online [cit. 2023-02-02]. ISSN 2375-2548. DOI 10.1126/sciadv.1700149. PMID 28508082. (anglicky)
- ↑ BUBNOV, M. M.; GUR’YANOV, A. N.; SALGANSKII, M. Yu. Reaction of germanium tetrachloride with oxygen under MCVD fiber preform fabrication conditions. Inorganic Materials. 2007-09, roč. 43, čís. 9, s. 968–971. Dostupné online [cit. 2023-02-02]. ISSN 0020-1685. DOI 10.1134/S0020168507090105. (anglicky)
- ↑ SAKAGUCHI, Shigeki; TODOROKI, Shin-ichi. Optical properties of GeO_2 glass and optical fibers. Applied Optics. 1997-09-20, roč. 36, čís. 27, s. 6809. Dostupné online [cit. 2023-02-02]. ISSN 0003-6935. DOI 10.1364/AO.36.006809. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Chlorid germaničitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Chlorid germaničitý na Wikimedia Commons
Média použitá na této stránce
Strukturní vzorec chloridu germaničitého, GeCl4
Autor: DrEricTäuscher, Licence: CC BY-SA 4.0
Čerstvě předestilovaný chlorid germaničitý, GeCl4.

