Chlorid joditý
| Chlorid joditý | |
|---|---|
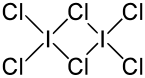 Struktura dimerního chloridu joditého | |
 Ampule s chloridem joditým | |
| Obecné | |
| Systematický název | Chlorid joditý |
| Anglický název | Iodine trichloride |
| Německý název | Iodtrichlorid |
| Sumární vzorec | I2Cl6 |
| Vzhled | žlutá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 865-44-1 |
| PubChem | 70076 |
| SMILES | ClI(Cl)Cl |
| InChI | 1S/Cl3I/c1-4(2)3 |
| Vlastnosti | |
| Molární hmotnost | 466,5281 g/mol |
| Teplota tání | 63 °C |
| Hustota | 3,11 g·cm−3 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Chlorid joditý je interhalogen, v pevném stavu vytváří dimerní molekuly I2Cl6. Dimer se skládá ze čtyř terminálních a dvou můstkových atomů chloru, strukturu lze popsat vzorcem Cl2I(µ-Cl)2ICl2.
Lze jej připravit reakcí jodu s nadbytkem kapalného chloru při teplotě −70 °C. V tavenině je vodivý, což lze vysvětlit existencí disociace:[2]
- I2Cl6 ↔ ICl +
2 + ICl -
4
Existence této rovnováhy byla potvrzena i strukturou některých solí, např. K[ICl2]·H2O nebo [ICl2][AlCl4].[2]
Je to silné chlorační[2] a oxidační činidlo, při kontaktu s organickým materiálem může vzplanout.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Iodine trichloride na anglické Wikipedii.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid joditý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid joditý na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Commercial sample of iodine trichloride
Iodine trichloride





