Chlorid měďný
| Chlorid měďný | |
|---|---|
 | |
| Obecné | |
| Systematický název | Chlorid měďný |
| Anglický název | Copper(I) chloride |
| Německý název | Kupfer(I)-chlorid |
| Sumární vzorec | CuCl |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 7758-89-6 |
| EC-no (EINECS/ELINCS/NLP) | 231-842-9 |
| PubChem | 62652 |
| ChEBI | 53472 |
| Číslo RTECS | GL6990000 |
| Vlastnosti | |
| Molární hmotnost | 98,999 g/mol |
| Teplota tání | 430 °C |
| Teplota varu | 1 212 °C |
| Hustota | 4,139 g/cm3 |
| Dynamický viskozitní koeficient | 2,54 cP (527 °C) 1,92 cP (607 °C) 1,44 cP (697 °C) |
| Index lomu | nD= 1,973 |
| Rozpustnost ve vodě | 1,25 g/100 g (25 °C) |
| Rozpustnost v polárních rozpouštědlech | kys. chlorovodíková roztoky amonných solí roztoky kyanidů |
| Součin rozpustnosti | 1,86×10−7 |
| Relativní permitivita εr | 10 (20 °C) |
| Měrná magnetická susceptibilita | −5,026×10−6 cm3g−1 |
| Povrchové napětí | 92 mN/m (450 °C) |
| Struktura | |
| Krystalová struktura | krychlová |
| Hrana krystalové mřížky | a=545,7 pm |
| Dipólový moment | 4,27×10−30 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −136,5 kJ/mol |
| Entalpie tání ΔHt | 103,5 J/g |
| Entalpie varu ΔHv | 219,2 J/g |
| Standardní molární entropie S° | 87,1 JK−1 mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −114,06 kJ/mol |
| Izobarické měrné teplo cp | 0,489 9 JK−1 g−1 |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | R22, R50/53 |
| S-věty | (S2), S22, S60, S61 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Chlorid měďný je anorganická sloučenina se vzorcem CuCl, binární chlorid mědi v nejnižším oxidačním čísle. Jedná se o bílou tuhou látku špatně rozpustnou ve vodě, avšak dobře rozpustnou v koncentrované kyselině chlorovodíkové. Nečisté vzorky jsou nazelenalé díky přítomnosti zeleného chloridu měďnatého.[2]
Vlastnosti

Chlorid měďný je Lewisovou kyselinou, klasifikovanou podle konceptu HSAB jako „měkkou“. Proto má tendenci tvořit stabilní komplexy s měkkými Lewisovými zásadami, například trifenylfosfinem:
- CuCl + P(C6H5)3 → [CuCl(P(C6H5)3)]4
Přestože se CuCl příliš nerozpouští ve vodě, rozpouští se ve vodných roztocích obsahujících vhodné donorové molekuly. Tvoří komplexy s halogenidovými ionty, například s koncentrovanou kyselinou chlorovodíkovou tvoří H3O+ CuCl2−. Podobně tvoří komplexy také s CN−, S2O32− a NH3.
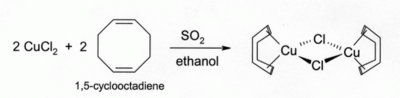
Roztoky CuCl s HCl nebo NH3 pohlcují oxid uhelnatý za vzniku bezbarvých komplexů, například dimeru s chloridovým můstkem [CuCl(CO)]2. Stejný roztok s HCl reaguje také s acetylenem na [CuCl(C2H2)]. Roztok s amoniakem dává s acetylenem výbušný acetylid měďný. Komplexy CuCl s alkeny lze připravit redukcí CuCl2 oxidem siřičitým za přítomnosti alkenu v alkoholovém roztoku. Komplexy s dieny, například 1,5-cyklooktadienem, jsou zvláště stabilní:[3]
Za nepřítomnosti jiných ligandů jsou vodné roztoky CuCl nestabilní vzhledem k disproporcionaci na měď a chlorid měďnatý.[4] Částečně z tohoto důvodu se CuCl na vzduchu zbarvuje dozelena.
Použití
Hlavním použitím chloridu měďného je jako prekurzor pro výrobu fungicidního oxychloridu měďnatého. Pro tento účel se CuCl generuje synproporcionací a pak se oxiduje vzduchem:
- Cu + CuCl2 → 2 CuCl
- 6 CuCl + 3/2 O2 + 3 H2O → 2 Cu3Cl2(OH)4 + CuCl2
CuCl katalyzuje mnoho organických reakcí. Jeho afinity k oxidu uhelnatému v přítomnosti chloridu hlinitého se využívá v procesu COPureSM.
Organická syntéza
V Sandmeyerově reakci vede působení CuCl na arendiazoniové soli ke vzniku arylchloridů, například:[5]
Tato reakce má široký záběr a obvykle nabízí vysokou výtěžnost.
Polymery
CuCl se používá jako katalyzátor v radikálové polymerizaci přenosem atomu (ATRP).
Reference
V tomto článku byl použit překlad textu z článku Copper(I) chloride na anglické Wikipedii.
- ↑ a b Copper(I) chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ United States Patent US4582579 "method of preparing cupric ion free cuprous chloride" Section 2, lines 4-41 , via www.freepatentsonline.com
- ↑ Nicholls, D. Complexes and First-Row Transition Elements, Macmillan Press, London, 1973.
- ↑ Greenwood, N.N.; Earnshaw, A. Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- ↑ (a) Wade, L. G. Organic Chemistry, 5th ed., p. 871, Prentice Hall, Upper Saddle RIver, New Jersey, 2003. (b) March, J. Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
- Mellor, J. W., A Comprehensive Treatise on Inorganic and Theoretical Chemistry, Volume III, pp157–168. Longmans, Green & Co., London, 1967 (new impression).
Externí odkazy
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
CuCl_Sandmeyer
Chlorid měďný, CuCl
CuCl_COD_dimer
Picture shows small (pure white) copper(I)chloride crystals on copper wire.