Chlorid molybdeničný
| Chlorid molybdeničný | |
|---|---|
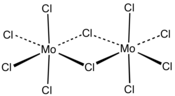 Strukturní vzorec | |
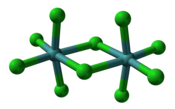 Krystalová struktura | |
| Obecné | |
| Systematický název | Chlorid molybdeničný |
| Anglický název | Molybdenum(V) chloride Molybdenum pentachloride |
| Německý název | Molybdänpentachlorid |
| Sumární vzorec | MoCl5 Mo2Cl10 (dimer) |
| Vzhled | tmavě zelená hygroskopická, paramagnetická pevná látka |
| Identifikace | |
| Registrační číslo CAS | 10241-05-1 |
| Číslo RTECS | QA4690000 |
| Vlastnosti | |
| Molární hmotnost | 273,21 g/mol |
| Teplota tání | 194 °C (467 K) |
| Teplota varu | 268 °C (541 K) |
| Hustota | 2,928 g/cm3 |
| Rozpustnost ve vodě | hydrolyzuje za vzniku kyseliny chlorovodíkové |
| Rozpustnost v polárních rozpouštědlech | rozpustný v bezvodém etheru a alkoholu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v organických rozpouštědlech |
| Struktura | |
| Krystalová struktura | jednoklonná |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Chlorid molybdeničný (MoCl5) je anorganická sloučenina, jeden z chloridů molybdenu.
Příprava a vlastnosti
Příprava
Tato sloučenina se připravuje chlorací kovového molybdenu nebo také oxidu molybdenového, protože chlorid molybdenový není možné na rozdíl od chloridu wolframového připravit za normálních podmínek.[2]
Vlastnosti
V pevném skupenství existuje chlorid molybdeničný v dimerní formě (Mo2Cl10), který má stejnou strukturu jako odpovídající chloridy wolframu, niobu a tantalu.
V plynném skupenství tvoří monomerní molekuly.
Je také paramagnetický.
Použití
Chlorid molybdeničný je důležitý prekurzor v přípravě ostatních sloučenin molybdenu.
Jedná se o silné oxidační činidlo.
MoCl5 je také Lewisova kyselina.
V organické syntéze je příležitostně používán k chloracím a deoxygenačním reakcím.[3]
Bezpečnost
MoCl5 je agresivní oxidant a při styku s vodou se rozkládá za vzniku kyseliny chlorovodíkové.
Reference
V tomto článku byl použit překlad textu z článku Molybdenum(V)chloride na anglické Wikipedii.
- ↑ a b Molybdenum pentachloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ T. Kauffmann, S. Torii, T. Inokuchi “Molybdenum(V) Chloride” in Encyclopedia of Reagents for Organic Synthesis 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid molybdeničný na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid molybdeničný na Wikimedia Commons - (anglicky) Molybdenum Pentachloride From the Elements
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Autor: CCoil (talk), Licence: CC BY 3.0
Ball-and-stick model of the molybdenum(V) chloride, Mo2Cl10, from the crystal structure.
X-ray crystallographic data from Acta Cryst. (1959). 12, 723-726.
Autor: Smokefoot, Licence: CC BY-SA 3.0
Chemical structure of "molybdenum pentachloride"



